La microscopía aplicada al diagnóstico
de las micosis sistémicas endémicas
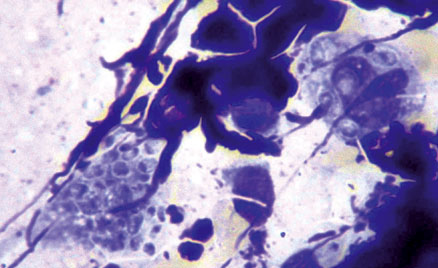
- Levaduras intracelulares de Histoplasma capsulatum en un extendido coloreado con la técnica de Giemsa, procedente de una lesión cutánea presente en un paciente con SIDA (1.000x).
Amadeo Javier Bava
Cátedra de Micología. Facultad de Ciencias Exactas. Universidad Nacional de La Plata. Sub – Programa Micología. Programa de Evaluación Continua de la Calidad (PEEC). FBA
Introducción
La microscopia constituye una herramienta de importancia en el diagnóstico de las micosis en general, y de las micosis sistémicas endémicas en particular. La rápida obtención de resultados y la disponibilidad del método en laboratorios de baja complejidad, se contraponen, en determinadas circunstancias, con sus bajas sensibilidad y especificidad. Debe además considerarse, a la hora de valorar su utilidad, la experiencia del observador, la cual requiere de horas de entrenamiento, y la provisión de un microscopio adecuado.
Las micosis sistémicas endémicas no se presentan en la práctica diaria con la frecuencia de las dermatofitosis, las candidiasis o las malasseziosis, no obstante, en nuestro medio, con el advenimiento de la pandemia del SIDA, una de ellas, la histoplasmosis, ha mostrado un incremento significativo respecto de épocas pretéritas.
Varios factores demoran habitualmente el diagnóstico de las micosis sistémicas endémicas, fundamentalmente la velocidad de crecimiento de sus agentes causales en los cultivos (a la cual debe sumarse en oportunidades el tiempo empleado en la identificación del aislamiento) y el tiempo requerido para realizar las pruebas serológicas específicas, cuyos antígenos se encuentran disponibles sólo en laboratorios especializados.
Las micosis sistémicas endémicas son, como su denominación lo explica, enfermedades frecuentes en determinadas regiones del planeta, en las cuales la forma saprobióntica del agente causal se encuentra en el ambiente. Los propágulos de estos hongos son inhalados por los moradores de estas regiones o bien por aquellos individuos que transitan esporádicamente por ellas, produciéndose una infección que en la mayor parte de los casos para inadvertida, como subclínica o inaparente.
El reconocimiento de esta primoinfección cuando es asintomática u ocasionalmente pausisintomática, constituye un hallazgo infrecuente y sólo puede determinarse mediante el empleo de pruebas cutáneas de lectura retardada, las cuales ponen en evidencia una respuesta inmunológica de hipersensibilidad retardada a los antígenos fúngicos específicos.
En cuanto al diagnóstico de certeza de la enfermedad, la cual clínicamente puede confundirse con la tuberculosis, otras micosis, otras infecciones o aún con cuadros no infecciosos, se basa en la aplicación métodos directos (microscopia y cultivos) e indirectos (determinación de anticuerpos específicos).
Ocasionalmente pueden emplearse técnicas más sofisticadas, dirigidas a la identificación de secuencias específicas de los ácidos nucleicos de los agentes causales mediante métodos moleculares o bien la determinación de los antígenos fúngicos en los fluidos biológicos. No obstante, estas últimas determinaciones no se encuentran al alcance de laboratorios de baja complejidad.
La microscopia, a pesar de sus limitaciones, adquiere especial relevancia en el caso de las micosis sistémicas endémicas, en vista de que el hallazgo de cualquiera de los agentes causales de las mismas, implica el diagnóstico de enfermedad.
La fase parasitaria de los agentes causales de estas micosis, están presentes en los materiales clínicos remitidos, principalmente fluidos biológicos (LCR, materiales de punción, orina, etc.) y tejidos obtenidos por biospsia. Las técnicas empleadas consisten básicamente en la microscopia en fresco (colocando una porción del material entre porta y cubreobjetos) y previa coloración (aplicando diferentes técnicas a extendidos previamente fijados).
La identificación de los hongos causantes de micosis sistémicas endémicas en cortes histopatológicos de tejidos, puede lograrse mediante la aplicación de técnicas inespecíficas, como la hematoxilina eosina (que además revela la reacción inflamatoria presente en las eventuales lesiones), o bien otras específicas para hongos, como la de Gomori – Grocott (o sus modificaciones rápidas) y la de PAS.
Diferentes técnicas de microscopia aplicadas al diagnóstico de las micosis sistémicas endémicas
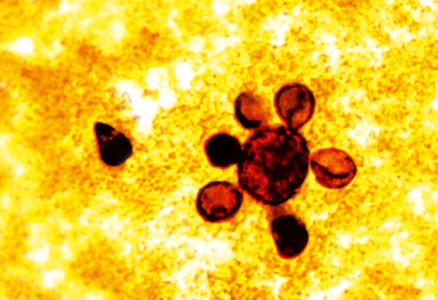
- Levadura de Paracoccidioides brasiliensis con múltiples brotes (“rueda de timón”), en un extendido coloreado con una modificación rápida de la técnica de Grocott (1.000x).
Microscopia en fresco
La microscopia en fresco permite observar sin dificultad, teniendo en cuenta sus características micromorfológicas particulares y su gran tamaño, a los agentes causales de la paracoccidioidomicosis y coccidioidomicosis.
El primero de ellos, Paracoccidioides brasiliensis, se presenta como células de tamaño y disposición variables (se toman como distintivas las grandes, de 20 µ a 60 µ de diámetro), de pared gruesa y refringente, ocasionalmente con múltiples brotes que le dan el aspecto de “rueda de timón” (Foto Nº 1). No obstante, esta descripción, a la cual podríamos denominar “paradigmática”, puede variar en ocasiones, dando lugar a levaduras pequeñas, con escasos o ningún brote, estar presente dentro del citoplasma de las células parasitarias a la manera de Histoplasma capsulatum, formar largas cadenas, etc. Han sido inclusive descriptas “formas aberrantes” o atípicas del hongo, cuando el mismo se halló en materias fecales de un paciente con la forma infanto – juvenil de la paracoccidioidomicosis.
Coccidioides immites, agente causal de la coccidioidomicosis, muestra en los tejidos elementos redondeados de gran tamaño denominados esférulas (hasta 300µ o más de diámetro) e interpretados por algunos como “esporangios” (Foto Nº 2). Ellas representan estadios evolutivos del hongo, por lo general con una pared refringente y gruesa (que puede ser fina en “esporangios de primoinfección”) y con un contenido compuesto de elementos redondos, de pequeño tamaño, llamados endosporos. Estos últimos son el producto de la fragmentación de contenido de la esférula y pueden ocasionalmente encontrarse fuera de ella, cuando es se rompe, y rodeada de leucocitos debido al potencial quimiotáctico de estas estructuras.
La observación de las levaduras de H. capsulatum en fresco es más difícil, aunque no imposible, debido a su escaso tamaño y su localización intracelular, motivo por el cual es preciso emplear coloraciones como la de Giemsa, PAS y Grocott para aumentar las posibilidades de observación, además del objetivo de inmersión (1.000x).
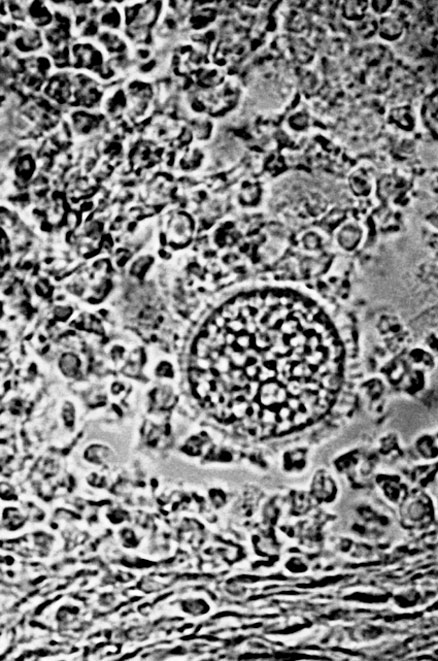
- Esférula de Coccidioides immitis en una preparación en fresco de tejidos de un ratón infectado experimentalmente (400x).
Coloración de Giemsa
Debido a su fácil disponibilidad en los laboratorios de baja complejidad, es una de las más empleadas, no obstante lo cual, sólo es aplicada al diagnóstico de la histoplasmosis, entre las micosis sistémicas endémicas.
En las preparaciones coloreadas con Giemsa, H. capsulatum es reconocido como levaduras por lo general presentes en el citoplasma de células fagocitarias, teñidas parcialmente (en forma de “casquete”), y rodeadas de una “falsa cápsula”, la cual dio el nombre al hongo (Foto Nº 3). Debido al pequeño tamaño de estas levaduras (2-5µ), debe emplearse el objetivo de inmersión (1.000x) para su mejor identificación.
Paracoccidioides brasiliensis es generalmente mal coloreado con esta técnica, no obstante en raras ocasiones permite su identificación, como células grandes, abolladas y multibrotadas.
Si bien nuestra experiencia con C. immitis no es tan rica como el los hongos anteriores, debido al escaso número de casos, no es recomendable el empleo de la técnica de Giemsa para la identificación de este hongo en materiales clínicos, prefiriéndose la microscopia en fresco y/o la coloración de Grocott.
Coloración de Grocott
Puede y debe ser empleada para identificar cualquiera de los agentes causales de las micosis sistémicas endémicas (y de las micosis en general, incluyendo la neumocistosis), ya sea en tejidos o en fluidos biológicos. Posee una sensibilidad aceptable, por lo cual es aconsejable su empleo cuando otras técnicas son negativas o se sospecha la presencia de escasos elementos fúngicos en la muestra.
Los elementos fúngicos se tiñen de color pardo (con diferentes tonalidades) o bien negro, lo que beneficia su localización sobre un fondo celeste o amarillento, según la técnica empleada. Posee sobre otras técnicas empleadas para la visualización de hongos, como la de PAS, la ventaja de teñir estructuras fúngicas no viables.
Coloración de PAS
Tiñe bien a los agentes causales de las micosis sistémicas endémicas (sobretodo es muy útil para identificar a H. capsulatum en cortes histopatológicos), aunque a diferencia del Grocott, puede ser deficiente para colorear los elementos fúngicos no-viables.
Más allá de la microscopia
El empleo de otras técnicas de diagnóstico diferentes de la microscopia en estas micosis pueden ser seguras, aunque requieren de reactivos especiales y emplean un tiempo mayor en arribar al diagnóstico.
La serología específica detecta la presencia de anticuerpos y sus resultados se encuentran disponibles 1 o 2 días después de la toma de la muestra, cuando se tiene al alcance un laboratorio especializado. Un resultado positivo implica la existencia de enfermedad en más del 95% de los casos, aunque puede presentar reacciones cruzadas con los anticuerpos presentes en otras micosis sistémicas endémicas.
Igualmente ocurre con la determinación de antígeno parietal de H. capsulatum en fluidos biológicos, el cual sólo se realiza en Centros de Referencia.
Las pruebas cutáneas de lectura retardada, no poseen valor diagnóstico y si pronóstico y epidemiológico, ya que pueden ser positivas en individuos sanos y negativas en aquellos enfermos.
El desarrollo de los agentes causales de las micosis sistémicas endémicas en cultivos es lenta y los mismos no deben descartarse como negativos hasta después de 30 o más días de incubación a 28º C y 37º C. Debe sumarse a esta demora, el tiempo empleado en la identificación final del hongo desarrollado, el cual es variable. La identificación de cepas por medio de exoantígenos, que acorta el tiempo requerido, necesita de reactivos no siempre disponibles.
La incorporación de las técnicas moleculares en el diagnóstico de estas micosis abre nuevas perspectivas, teniendo en cuenta su elevada sensibilidad y la posibilidad de su aplicación a numerosos materiales clínicos y a cepas aisladas. Existen equipos comerciales que permiten la rápida identificación de los aislamientos dudosos por estas técnicas.
| Referencias Bibliográficas |
- Bava AJ. Histoplasmosis in the Muñiz Hospital of Buenos Aires”. Rev Inst Med Trop Sao Paulo 1995; 37; 531-535.
- Bava AJ, Negroni R, Arechavala, Robles AM, Curzio D, Di Dioia P. Estudio de 8 casos de Coccidioidomicosis en el Hospital Muñiz de Buenos Aires. Rev Iberam Micol 1999; 16; 111-113.
- Bava AJ & Alvarez Guidi G. Paracoccidioides brasiliensis en materia fecal. Acta Bioquím Clín Latinoam 2006: 40; 391-394.
- Bava AJ. Coloración rápida para la identificación de quistes de Pneumocystis carinii en materiales respiratorios. Acta Bioquím Clín Latinoam 2003: 37; 189-192.
- Brummer E, Castañeda E, Restrepo A. Paracoccidioidomycosis: Un Update. Clin Microbiol Rev 1993; 6; 89-117.
- Di Caudo DJ. Coccidioidomycosis: A review and update. J Am Acad Dermatol 2006; 55: 929-42
- Kauffman CA. Histoplasmosis: a Clinical and Laboratory Update. Clin Microbiol Rev. 2007; 20, 115–132.
- Negroni R, Guelfand L. Manual de Procedimiento para Laboratorios de Micología Médica. Acta Bioquím Clin Latinoam 1999; (Suplemento 1).
- Rubinstein P, Negroni R. Micosis broncopulmonares del adulto y del niño. 2a. ed. Editorial Beta. Buenos Aires. 1981.
- Sarosi GA, Davies SF. Endemic mycosis complicating human immunodeficiency virus infection. West J Med 1996; 164: 335-340.
- Wheat J. Endemic Mycoses in AIDS: a Clinical Review. Clin Microbiol Rev 1992; 8, 146-159.
|
|
|