El virus del papiloma humano también es responsable de cánceres orofaríngeos
Aunque el HPV se conoce como causa del cáncer cervical y cánceres genitales, también es responsable del creciente número de cánceres orofaringeos, particularmente entre hombres. Se estima que alrededor del 30% de los cánceres orofaríngeos en el mundo son HPV relacionados. Siendo el HPV 16 el principal tipo viral asociado con estos cánceres.
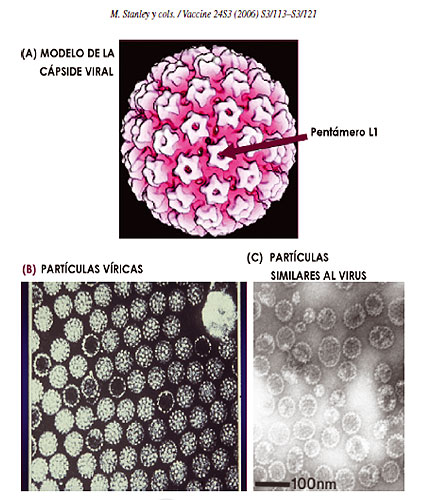
 Estructura del virus: Estructura del virus:
Los Papilomavirus son DNA virus, pequeños, sin envoltura, tienen un diámetro de 52 -55 nm. Las partículas virales consisten en una única molécula de ADN de doble cadena circular de alrededor de 8000 pares de bases estabilizadas por histonas celulares y contenidas en una cápside proteica compuesta por 72 capsómeros pentaméricos. La cápside contiene dos proteínas estructurales tardías, L1 (de 55 Kda; 80% del total de la proteína viral) y L2 (de 70 Kda), las cuales están viralmente codificadas. VPL (partículas semejantes al virus) pueden producirse por la expresión de L1, sola o en combinación con L2, en sistemas de expresión de mamíferos o no mamíferos.
El virión intacto tiene una densidad de 1,34g/mL en cloruro de cesio y un coeficiente de sedimentación de (S20 ,W) de 300 (Kirnbauer et al., 1992; Hagensee et al.,1993a)
|
Por Estela I. Albanesi,
Lic en Ciencias Bioquímicas
MP: 3659
El Papilomavirus es un virus pequeño, sin envoltura, que infecta mucosas y epitelios cutáneos de una amplia variedad de vertebrados superiores de modo especie-especifico induciendo la proliferación celular. Sólo en bovinos (BPVs) se conoce la infección en mesenquima. Mas de 100 tipos de HPVs han sido identificados y poco menos de la mitad de ellos infectan el tracto genital. Muchos tipos tipos de HPVs han sido encontrados en cánceres cervicales, mientras que otros nunca o raramente han sido encontrados en un gran número de cánceres, lo cual genera la división en dos grandes grupos: HPVs de “Alto riesgo” y HPVs de “bajo riesgo”.
En pacientes con Epidermodisplasia verruciforme se han encontrado varios tipos de HPVs, estos tipos también se han encontrado en cánceres no melanómicos y en piel normal.
Todos los papilomavirus comparten una estructura genética común que es diferente de la de los poliomavirus, familia en la cual fueron incluidos antes inicialmente. Un genoma de doble cadena circular ADN codifica aproximadamente 8 regiones abiertas de lectura. De igual modo, todos los papilomavirus tienen una cápside proteica icosaédrica, sin envoltura lipídica.
El estudio del ciclo natural de la infección fue obstaculizado por la imposibilidad de cultivar el virus y por la falta de modelos animales.
Con la posibilidad del clonado molecular del genoma del HPV, en los comienzos de la década del 80, se consiguió estudiar los genes individualmente por primera vez. Sin embargo recién hacia fines de la década del 90 se pudo propagar el virus en cultivos organotípicos. Actualmente, el virus puede cultivarse, en investigaciones, con una técnica llamada “raft culture”, es un tipo de cultivo en estratos celulares, cultivo en células con capacidad de diferenciación, muy distinto de los cultivos en monocapa utilizados para visualizar efectos citopáticos virales. Los resultados de la aplicación de esta técnica fueron mostrados por el Presidente de la Sociedad Internacional de papilomavirus, Thomas Broker, en nuestro país en el año 2008.
Se realizaron progresos notables para definir la actividad de las oncoproteínas virales, en particular de las oncoproteinas de los tipos 16 y 18, que promueven la disrupción del control del ciclo celular normal. La capacidad de dirigirse a la familia de proteínas de retinoblastoma y p53 y de inducir la telomerasa son algunos de los eventos críticos que contribuyen al desarrollo de la malignidad.
Genoma, proteínas y ciclo de vida del HPV
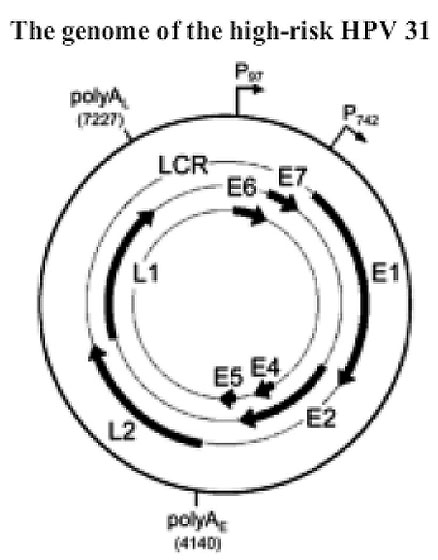
El genoma de todos los tipos de HPVs contiene aproximadamente 8 regiones ORF que son todas transcriptas de una única cadena de ADN. La región ORF puede ser, a su vez, dividida en tres partes funcionales: la región temprana (E) que codifica las proteínas (E1-E7), necesarias para la replicación viral; la región tardía (L) que codifica las proteínas estructurales (L1 – L2) que son necesarias para el ensamblaje del virión; y la región de control no codificante (LCR: long control region) la cual contiene elementos necesarios para la replicación y transcripción del ADN viral.
Las proteínas E1 y E2 actúan como factores de reconocimiento de origen de replicación; E2 es también el principal regulador de la transcripción del gen viral. E4, a pesar de su nombre, se cree que está involucrada en estadios tardíos del ciclo de vida viral, E5 podría funcionar durante ambas fases, temprana y tardía. Las oncoproteinas E6 y E7 orientan un número de reg8uladores negativos del ciclo celular, primariamente p105 Rb y p53, respectivamente. Durante ciclo de vida viral, E6 y E7 estabilizan el episoma viral y estimulan la diferenciación ce8lular para volver a entrar en fase S. Las proteínas L1 y L2 ensamblan en capsómeros, los cuales forman cápsides icosaédricas alrededor del genoma viral durante la generación de la p8rogenie viral (Fehrmann & Laimins, 2003).
En el diagrama se indica región abierta de los genes tempranos y tardíos, la zona de control LCR, los mayores promotores que conducen a la expresión viral (p97 y p742) y los dos sitios de poliadenilación (AE 4140 y AL7227).
Infecciones productivas
Los Papilomavirus son altamente epiteliotropos; específicamente, establecen infecciones “productivas” solamente dentro de epitelios estratificados de la piel, del tracto anogenital y de la cavidad oral. El ciclo de vida viral está vinculado a la diferenciación celular del epitelio infectado. El ciclo viral se inicia con la infección de la capa basal de células epiteliales, presumiblemente en sitios de injuria a través de microdesgarros o microabrasiones epiteliales. Aunque han sido reportados varios receptores potenciales, no está aclarada su importancia fisiológica.
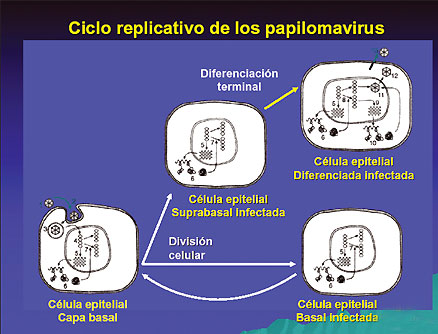
El genoma viral se establece en la capa de células con capacidad de división (ver figura 1) cuando expresa preferencialmente un bajo número de copias, el plásmido nuclear y los genes tempranos aunque a bajos niveles. La habilidad del HPV de establecer su genoma en células basales depende de los genes E1, E2, E6 y en algunos casos de E7. Normalmente cuando las células basales entran en división celular, la célula hija que pierde el contacto con la membrana basal y migra al compartimiento suprabasal es retirada del ciclo celular e inicia un programa de diferenciación terminal. Sin embargo, en keratinocitos humanos y células del epitelio cervical HPV +, las células suprabasales fallan al retirarse del ciclo celular, manteniendo la síntesis de ADN y expresando marcadores para la proliferación celular.
La presencia de E7 del HPV 16 ha mostrado ser necesaria y suficiente para inducir la síntesis de ADN en células suprabasales, la oncoproteína E5 contribuye cuantitativamente a esta propiedad en HPV 16 y en HPV 31. Dentro del compartimiento suprabasal, las células mantienen la amplificación del genoma viral, la expresión del genoma de la cápside y ensamblan el genoma a la cápside. L2 interviene en la encapsidación del ADN para generar la progenie viral dentro del compartimiento de células diferenciadas terminales.
Para establecer una verruga o papiloma, el virus debe infectar células basales del epitelio. Pasos iniciales en el ciclo de replicación tales como: (1) Adhesión, (2) internalización, (3) endocitocis, (4) transporte hacia el núcleo y decapsidación, (5) transcripción de la región E, (6) transporte de las proteínas E, (7) se mantiene el estado de replicación del ADN viral. Todo ocurre en las células basales y en las células suprabasales.
Los eventos del ciclo de vida viral que conducen a la producción de viriones que ocurren en keratinocitos diferenciados: (8) replicación vegetativa del ADN viral, (9) transcripción de la región L, (10) producción de las proteínas de la cápside L1 y L2, (11) ensamblado de las partículas virales, (12) rotura nuclear, (13) liberación del virus.
Infecciones no productivas
En el contexto del HPV asociado al cáncer cervical, el ciclo de vida es perturbado de dos modos fundamentalmente. Primero, los cambios histopatológicos progresivos que aparecen en el epitelio cervical, incluye la pérdida de la diferenciación terminal. Esta inhibición del proceso de diferenciación conduce a un estado celular que no puede mantener el ciclo de vida viral completo. Segundo, el genoma ADN circular, el cual normalmente reside como plásmido nuclear, a menudo comienza a integrarse en el genoma del huésped y comienza a perturbar y hace la replicación defectiva. No está claro si la integración es una propiedad del virus o un evento al azar, sin embargo dos consecuencias de la integración pueden ser: I) la selectiva sobre-regulación de los oncogenes virales E6 y E7 y II) el crecimiento selectivo, de esas células con integración, sobre las células que albergan al genoma viral como plásmido. Los eventos de integración que se encuentran en el cáncer cervical conducen a la sobre-expresión selectiva de las oncoproteinas E6 y E7, lo cual es una marca distintiva del cáncer cervical.
Es muy importante destacar que la relación entre la infección con el HPV y el desarrollo del cáncer cervical ha sido bien establecida, no existe cáncer cervical sin historia previa de infección con el HPV de alto riesgo. La infección es considerada causa necesaria pero no suficiente para el desarrollo de la lesión precancerosa o el cáncer. Es remarcable que la infección es muy común, de alta prevalencia entre mujeres jóvenes y que es, en el 90% de los casos autolimitada por el sistema inmunológico, se cura sin tratamiento alguno, a veces pueden ser indicadas vitaminas o bien tratar de disminuir los factores de riesgo asociados con la progresión al cáncer, como disminución del habito de fumar, beber alcohol, entre otros.
Respuesta serológica: propiedades antigénicas de las proteínas del virión HPV
El estudio de la inmunidad al HPV ha sido obstaculizada debido a la dificultad de obtener viriones de cultivos celulares y a que la producción de virus infecciosos esta estrictamente vinculada a la diferenciación de células epiteliales.
Los estudios iniciales usaron viriones obtenidos de materiales obtenidos de verrugas. La inoculación experimental de viriones de HPV principalmente HPV1 en animales, mostró que la inoculación de viriones desnaturalizados provocan anticuerpos que generalmente dan reacción cruzada con entre tipos de papilomavirus, mientras que los viriones intactos inducen anticuerpos que son en gran parte, tipo específicos. El descubrimiento de que la proteína L1 puede autensamblarse en VPLs (partículas semejantes al virus) y que son estructural e inmunoquímicamente indistinguibles del auténtico virión ha provisto de una herramienta valiosa para estimular y dirigir grupos de investigación hacia el diseño de vacunas terapéuticas y profilácticas. L a vacunación con L1 VPL genera un alto titulo de anticuerpos neutralizantes y confieren protección contra la infección.
Funciones de las proteínas de los papilomavirus
E1: Necesaria para la replicación viral
E2: Principal regulador de la transcripción del gen viral
E4: Interviene tardíamente en el ciclo de vida viral, se cree que facilita el ensamble y la liberación.
E5: Induce la proliferación celular no programada
E6: Induce la síntesis de ADN, inductor de telomerasa, impide la diferenciación celular, interactúa con 4 clases de proteínas celulares entre las que se encuentra la la p53 supresora de tumores.
E7: Induce la proliferación no programada de la célula, interactúa con reguladores negativos del ciclo celular y supresores de tumores como la proteína del retinoblastoma, p105Rb.
L1: Mayor proteína estructural, cápside viral, interactúa con L2.
L2: Menor proteína estructural, interactúa con ADN, se cree que facilita el ensamblaje.
|
Tipos de respuesta inmune frente al HPV
En la mucosa la respuesta inmune es compleja por cuanto se compone, no sólo de lo que se considera como innato y adaptativo sino que también incluye a las inmunoglobulinas segregadas localmente que desempeñan un papel importante en las defensas inmunológicas. La respuesta innata constituye respuestas de naturaleza inespecífica. En la mucosa vaginal/cervical este tipo de respuesta es muy compleja debido a la presencia de la microbiota habitual. Además, el sistema innato está encargado de desencadenar la respuesta adaptativa, la cual es altamente específica y con capacidad de memoria. La inmunidad humoral mediada por anticuerpos elimina las partículas virales libres y puede prevenir la re-infección. La inmunidad inmunocelular elimina el virus de las células infectadas y genera también memoria inmunitaria. Si bien es razonable que el control del HPV debería involucrar estos tres tipos de inmunidad, la evidencia obtenida hasta la fecha sigue siendo difícil de interpretar, debido a que pocos estudios utilizan técnicas serológicas en los estudios de la historia natural de la infección. Además esto se ve exacerbado por la variabilidad de los antígenos diana y de los ensayos.
Inmunidad innata y HPV
Mayoritariamente las partículas virales son liberadas por procesos normales de descamación sin muerte ni lisis celular. Por lo tanto, no hay proceso inflamatorio que estimule al sistema inmune innato. Sin embargo hay evidencia clínica y analítica que muestra la importancia del sistema innato de defensa en el control del virus. Por ejemplo, las mujeres afectadas por infecciones HPV transitorias tienen menos probabilidad de desarrollar respuestas de anticuerpos o respuestas celulares que las mujeres que son afectadas por infecciones persistentes, lo cual sugiere que la respuesta inmune innata puede eliminar rápidamente los antígenos virales antes de que se desarrollen respuestas de memoria. La respuesta innata es muy compleja, hoy se sabe que incluye patrones complejos de reconocimiento de patógenos (por ejemplo receptores Toll-Like), mecanismos efectores innatos como quimiotaxis y el rol del sistema innato como puente hacia la inmunidad adaptativa.
Repuesta inmune humoral
La gran mayoría de estudios respaldan el pobre efecto protector contra la persistencia del HPV o la enfermedad provocada por el mismo. El desarrollo de anticuerpos específicos es característico de las mujeres con exposición prolongada al HPV, siendo nulo en las mujeres que eliminan el virus por mecanismos innatos de defensa.
La existencia de infecciones persistentes demuestra que el sistema innato es muchas veces sorteado. El periodo que transcurre entre la infección del keratinocito basal y la aparición de lesiones es muy variable, lo cual pone de manifiesto la capacidad que tiene el virus de “esconderse” del sistema inmune durante varios meses e incluso durante años. Existe una sólida evidencia clínica en relación a la importancia de las respuestas inmunitarias mediadas por células en la regresión viral, una vez establecida la infección. Los elementos considerados importantes para el control celular, como ya se ha mencionado, son las oncoproteinas E6, E7 y E2.
Existe poca evidencia de reactividad cruzada de anticuerpos en suero humano. Las evidencias hasta hoy indican que la respuesta a la infección es tipo específica. El resultado mas consistente de estudios que investigaron la respuesta inmune en la infección fue el hallazgo de los anticuerpos contra la proteína E7 del HPV16 asociados con el cáncer cervical y con cánceres de células escamosas de cavidad oral y orofaringe, con un rango de riesgo relativo de 2.5 a 30. También se encontraron elevados los anticuerpos contra E6 en pacientes con cánceres cervicales, orales y orofaríngeos comparados con controles. En tumores HPV 16 + la seropositividad fue variable, entre el 25 y el 50%. No hay elevación de seropositividad en individuos con lesiones preneoplásicas tales como carcinoma “in situ”.
Los anticuerpos contra las proteínas E6 y E7 no sirven como marcadores pronóstico de progresión. Algunos estudios realizados con HPV 11, en mujeres con verrugas recurrentes, han demostrado una sólida asociación entre la seropositividad y la infección en situaciones de exposición prolongada o repetida al antígeno HPV para desarrollar una respuesta inmune detectable.
Un gran número de estudios han examinado seroreactividad usando VPL HPV 16, la comparación del porcentaje de seropositivos se hace difícil entre estos estudios por las diferencias en la elección de los valores de corte de la técnica empleada ( ELISA). Es un área de intenso estudio la búsqueda de correlación entre seromarcadores y enfermedad HPV relacionada o con la detección de ADN viral.
Aunque existe consenso en que los HPVs genitales son transmitidos principalmente por vía sexual, existen datos controversiales sobre si existe la transmisión no-sexual.
Una serie de estudios transversales han demostrado que la respuesta IgA específica para HPV VPL correlaciona con la respuesta IgG o con la detección del DNA HPV del mismo tipo especifico. En un estudio reciente que examina la aparición de anticuerpos de clase IgA en una infección con HPV 16, la mediana de tiempo para detectar anticuerpos desde la detección primaria del DNA HPV 16 fue 10,5 meses para IgA en secreciones cervicales y 19,1 meses para la IgA sérica. La seroconversión de anticuerpos de clase IgA fue observada con menos frecuencia y ocurre mas tardíamente que la conversión cervical de IgA o la seroconversión de IgG. La perdida de los anticuerpos IgA en secreción cervical fue rápida, 12 meses; la perdida para anticuerpos sericos IgA fue de 13,6 meses.
En conclusión, el desarrollo de la respuesta dirigida a los antígenos HPV no está aún claro. Esto es en parte debido al hecho de que en los diferentes estudios se usan distintos marcadores, lo cual resulta en conclusiones inconsistentes.
Debido a que varios estudios no han encontrado una fuerte asociación con la enfermedad, estos enfoques han recibido poca atención. La seropositividad para E6 y E7 es una clara consecuencia del desarrollo del tumor, pero no se sabe si otros factores que prolongan la exposición al antígeno influyen en la seropositividad.
Biomarcadores
En relación con la búsqueda de biomarcadores de pronóstico de enfermedad, el reciente comunicado de N°219, de la International Agency for research on Cancer, IARC, de junio de 2013, indica que mas del 30% de los pacientes con cánceres diagnosticados de orofaringe, tenían 10 años antes del diagnóstico, seropositividad para los anticuerpos E6 del HPV 16, comparado con el escaso 1% de pacientes que tenían estos anticuerpos pero no habían desarrollado enfermedad. Este estudio enroló a 500.000 personas de 10 países europeos en el año 1990 y son monitoreados desde entonces.
Según el autor del estudio, Dr. Paul Brennan, se intenta entre otros objetivos, obtener biomarcadores sanguíneos para la detección temprana del cáncer oral sexualmente transmitido. Aunque el HPV se conoce como causa del cáncer cervical y canceres genitales, es también responsable del creciente número de canceres orofaringeos, particularmente entre hombres. Los cánceres orofaríngeos incluyen los canceres de lengua, la parte oral de la faringe, paladar blando y base de la lengua.
Se estima que alrededor del 30% de los canceres orofaríngeos en el mundo son HPV relacionados. Siendo el HPV 16 el principal tipo viral asociado con estos cánceres. El cáncer orofaringeo ha sido un cáncer poco común y casi siempre vinculado al alto consumo de tabaco y alcohol. Pero hace unas pocas décadas atrás su incidencia se ha incrementado dramáticamente en muchas partes del mundo, especialmente en Europa y América del Norte, quizás porque allí exista un buen registro de casos, quizás porque la población tenga diferentes costumbres o hábitos sexuales, sean cuales sean las razones son mandatorias de atención de grupos de investigación en pos de la prevención del cáncer.
Breve comentario sobre la vacuna
En nuestro país se ha incorporado al calendario de vacunación obligatorio y gratuito la vacuna contra el HPV de alto riesgo, bivalente que incluye dos genotipos de alto riesgo, HPV16 y HPV 18. También existe y está aprobada por las autoridades sanitarias de nuestro país, el ANMAT, la vacuna tetravalente que incluye dos genotipos virales de bajo riesgo, HPV 6 Y HPV 11 que evita las verrugas comunes y en especial la papilomatosis laríngea recurrente.
En los centros de vacunación se habla de la vacuna contra el cáncer de cuello uterino, es importante destacar que además de evitar el 70% de todos los cánceres de cuelo de útero, evita también los segundos primarios con localizaciones orofaríngeas.
Si bien es cierto que es la segunda vacuna en la historia de la humanidad que previene un cáncer (la primera fue la vacuna contra la hepatitis B que previene el cáncer hepático) sería más acertado darla a conocer como la vacuna contra el Virus Papiloma Humano o HPV, pues también pueden vacunarse varones, sólo en el ámbito de la sanidad pública se ha incorporado en niñas por cuestiones vinculadas mas a la vacunología o logística de vacunación. Los varones tendrán un efecto protector denominado “efecto rebaño” aunque pueden también vacunarse, para los niños no es gratuita y obligatoria.
Debe pensarse que la Argentina es pionera en este esfuerzo sanitario cuyo beneficio sólo podrá verse cuando las niñas nacidas en el año 2000 cumplan la edad de mayor incidencia de Cáncer de Cuello de Útero, o sea dentro de 20 años aproximadamente.
Es necesario aunar esfuerzos para conseguir adhesión al esquema de vacunación. Se necesita del apoyo político para lograr que los programas de vacunación sean efectivos. Un paso importante en esa dirección es informar a la comunidad sanitaria y al público en general con claridad y honestidad sobre el HPV, su asociación con el cáncer de cuello de útero y otras localizaciones relacionadas con el HPV.
Existe una necesidad urgente de desarrollar programas de educación sexual que incluyan este tema para romper todos los mitos en torno a la transmisión sexual del virus.
Existe consenso internacional sobre el abordaje en adolescentes del tema HPV. Es mejor aggiornar a los jóvenes desarrollando el tema desde la prevención del cáncer mas que de una infección de transmisión sexual.
La población general debe saber que casi todos los individuos sexualmente activos contraerán una infección por HPV en algún momento de sus vidas y que la prevención de esta infección mediante la vacuna conlleva a la prevención del desarrollo de un cáncer. Que la infección por HPV no se trata y que no es necesario conocer el estado inmune frente al HPV para la aplicación de la vacuna.
Fuente bibliográfica
- Vaccine 2007
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans.
Volume 90
|
|

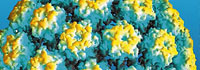

 Estructura del virus:
Estructura del virus:
