 |
|||
|
| ARG |
Científicos argentinos
Por Ana M. Pertierra Hasta el momento no existen fármacos antivirales específicos ni vacunas para combatir el virus sincicial respiratorio humano (VSR), el principal agente responsable de la bronquiolitis, una infección de las vías respiratorias inferiores que, a partir del otoño, puede producir cuadros severos que requieren internación y neumonías antes de los 2 años de edad. -Usted y su equipo de investigación han aislado y caracterizado dos proteínas claves para la replicación del virus sincicial respirtario (VSR), las proteínas P y M2-1. ¿Con qué metodología han trabajado para arribar a esos resultados? - Los virus son en última instancia entidades biológicas mínimas, en principio reducibles a la química que está detrás de sus actividades biológicas, cuya complejidad aumenta sustancialmente dentro de una célula. Gran parte de los virus son “solo” un puñado de genes que producen las respectivas proteínas las cuales participan en el ciclo de vida del virus. No obstante, este puñado de proteínas es suficiente para causar el daño que causan. El virus respiratorio sincicial (VRS) es un virus pequeño con genoma de ARN y envoltura de membrana. Consta solamente de unas 11 proteínas (11 genes), las cuales determinan las actividades esenciales del virus como su ingreso a la célula, interferencia con la respuesta inmune, replicación del genoma, ensamblado, salida de la partícula viral, y exposición al sistema inmune. La comprensión de los mecanismos de estas reacciones bioquímicas, que involucran ensamblado, interacción entre proteínas e interacción con ARN, son la base para el desarrollo de antivirales, vacunas, y métodos de diagnóstico.
¿Qué función específica cumplen dichas proteínas y en qué lugar de la estructura del virus se encuentran? El trabajo publicado recientemente en la revista Biochemistry completa una serie de tres trabajos sobre las mismas proteínas. Una de ellas, llamada fosfoproteína o proteína P, es un cofactor, o sea un componente esencial del complejo de la ARN polimerasa, enzima fundamental para la replicación del genoma del virus. La otra proteína se denomina M2-1 y tiene como función favorecer la transcripción de todos los genes virales, y es por tanto, también esencial en el ciclo de vida del virus. Esta proteína es única en este tipo de virus, lo que la hace ideal para el desarrollo de antivirales específicos. Ambas proteínas forman parte del complejo polimerasa y se encuentran en el interior de la partícula viral. ¿Cuánto tiempo les demandó este trabajo de investigación? Este trabajo de investigación es un capítulo o etapa dentro de un proyecto global de muchos años, como la raíz de un gran árbol. Cuanto mas sólida y extendida la raíz, mas robusto el árbol. Este trabajo es un conjunto de preguntas científicas, a través de hipótesis y experimentos, que dio el fruto mencionado. Este capítulo llevó aproximadamente un año y medio. Pero es parte de un proyecto amplio que comenzó hace cuatro años y en estos momentos comienza a dar frutos a través de estas y otras áreas en las que estamos interesados relacionadas a este virus de tanta importancia en los hospitales, y no se restringe a los públicos.
¿Qué repercusión ha tenido entre la comunidad científica internacional este trabajo que acaban de publicar en la revista científica Biochemistry? La repercusión en la comunidad científica se da a través de la cantidad de investigadores de diversas partes del mundo que “bajan” el trabajo de los sitios de internet y lo citan en sus propios trabajos, generando la pirámide del conocimiento. Por lo tanto, no es inmediato. No obstante, hemos presentado una conferencia de este trabajo en un congreso internacional de este tipo de virus, y ha tenido muy buena recepción. La repercusión entre la comunidad internacional de pares suele ser lenta, pero robusta si es trabajo de calidad y se publica en revistas de altos estándares como lo es Biochemistry. Obtenido este conocimiento, ¿cuáles serán los futuros pasos de sus investigaciones para avanzar en estrategias para combatir este virus? El análisis gradual e integral de todas las proteínas del virus permite generar y exponer oportunidades para intervenir en todos los frentes de combate contra un virus. Por ejemplo, muchas de estas proteínas sirven de antígenos o reactivos para ser utilizadas en diagnóstico. A su vez, algunas de ellas están siendo analizadas por laboratorios internacionales especializados como potenciales vacunas. Como dije anteriormente, cada reacción de alta especificidad que no interfiera en la célula es un blanco plausible para el diseño de fármacos antivirales. ¿Será posible desarrollar antivirales específicos y eficaces contra este virus en un futuro próximo en el país? ¿Cuál es el mayor obstáculo para el desarrollo de una vacuna contra el VSR: la mutabilidad del virus o la condición inmunológica del huésped que se quiere proteger, en este caso niños menores de dos años? Si bien tengo conocimiento de este tema, estoy lejos de ser experto y preferiría que esto lo hable con un médico infectólogo especialista en VRS. Lo que yo puedo afirmar es que la primera vacuna que se probó contra el VRS en los años 60, en base a virus inactivados, que era lo que se usaba en esa época, fue uno de los fiascos más importantes que ocurrieron en el área de vacunación, porque incrementó la severidad de la enfermedad en los vacunados, llegando a casos fatales. En este momento hay diversas vacunas prometedoras en pruebas clínicas, pero ninguna cerca del mercado. Existen aspectos inmunológicos intrincados que hacen que una vacuna para VRS no sea tarea fácil, y la mala experiencia ocurrida, hizo que se proceda con la mayor precaución.
|
||
| Subir | ^ |
 |
| Científicos argentinos Hallan un blanco clave para combatir el virus de la bronquiolitis |
 |
| El virus del papiloma humano también es responsable de cánceres orofaríngeos |

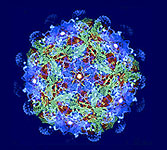 Virus Respiratorio Sincicial
Virus Respiratorio Sincicial 