Investigación:
Factor de crecimiento placentario: PlGF
marcador bioquímico de preeclampsia
El Comité de Redacción de Acta Bioquímica Clínica Latinoamericana ha seleccionado este artículo publicado en la revista INFORME ALAC – Año XXI – Nº 1 - 2016, pp. 14-19, para su difusión a través de FABAInforma.
Bioq. Especialista en Endocrinología Marcela Barbera
Dep. Endocrinología. IACA Laboratorios endocrinologia@iaca.com.ar
Introducción
La insuficiencia placentaria es la incapacidad que tiene la placenta para cumplir con los requerimientos necesarios del feto, y esto tiene tanto consecuencias maternas como fetales.
En la madre se produce una disfunción endotelial que lleva a estados hipertensivos durante la segunda mitad el embarazo. En el feto hay un retraso del crecimiento intrauterino (RCIU) por falta de aportes nutricionales y respiratorios por parte de la placenta.
La Preeclampsia (PE) se caracteriza por presión arterial (PA) sistólica ≥ 140 mmHg y/o PA diastólica≥ 90 mmHg en dos mediciones con diferencia de al menos 6 horas, a partir de la semana 20 de gestación, en mujeres que previamente han sido normotensas. Esto, asociado a una proteinuria ≥ 300 mg/24 horas o ≥ 30 mg/dL en dos orinas ocasionales con una diferencia de 6 horas entre una y otra (1).

• Fig 1. Consecuencias de la PE ( Actualización en medicina metarnofetal. Dr. Francesc Figueras)
Es una patología propia del embarazo y sólo se tratan los síntomas, pero si el tratamiento no es adecuado y precoz puede llevar a complicaciones graves tanto para la mujer como para el feto. La hemorragia cerebral, el síndrome HELLP (hemólisis, elevación de la enzimas hepáticas y recuento bajo de plaquetas) y la coagulación intravascular diseminada (CID) son las causas principales de muerte en mujeres gestantes con PE.
En el caso de los neonatos, la tasa de mortalidad perinatal está aumentada entre 5 y 30 veces en comparación con los fetos que no tuvieron RCIU. También hay una mayor incidencia de asfixia durante el parto, hipoglucemia e hipotermia neonatal que en aquellos que no han padecido esta patología. Los niños que al momento del nacimiento han sido diagnosticados con RCIU tienen un riesgo de 2 a 8 veces mayor de padecer obesidad, hipertensión arterial (HTA) o diabetes mellitus 2 durante la adultez (2).
La detección temprana o "screening" es sumamente importante para prevenir estas patologías. El objetivo de realizar un screening es descubrir enfermos entre una población aparentemente sana. Según Cukle Wald, hay requerimientos para implementar un plan de tamizaje (3):
• La enfermedad debe ser conocida y de alta prevalencia.
• La prueba a realizar debe ser simple, inocua, y altamente sensible.
• El tratamiento debe ser efectivo.
• Se debe evaluar el costo-beneficio de realizar el screening.
En el caso de la PE, se discute que no hay un tratamiento eficaz para realizar prevención. Sin embargo, monitoreando las arterias uterinas y administrando aspirina, se reducen significativamente las complicaciones (4).
Fisiopatología
La PE es una enfermedad sistémica aunque se inicia con un mal funcionamiento de la placenta. Sin embargo, la falla placentaria solamente, no es suficiente para dar origen al síndrome materno. Existen factores de riesgo que predisponen a una disfunción endotelial como son la HTA, diabetes mellitus, trombofilias, etc., por parte de la madre. Hay una serie de factores constitucionales maternos que influyen en la variedad y la gravedad de la clínica.
En resumen, la PE se concibe como un trastorno que se establece en dos fases: la primera, en el establecimiento de una deficiente circulación placentaria en el inicio del embarazo (hipoxia placentaria) y la segunda, en la respuesta sistémica materna al final de la gestación.
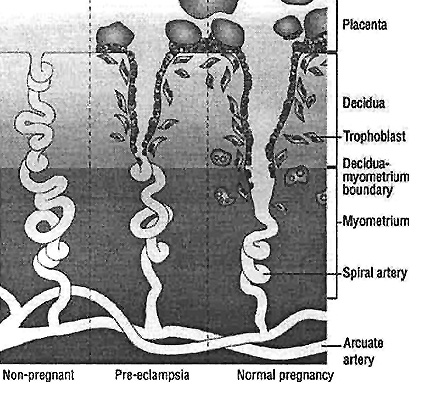
1 - Establecimiento de una deficiente circulación placentaria: Se caracteriza por una falla en la invasión trofoblástica temprana de las arterias espiraladas maternas y como consecuencia de esto se produce una disminución de flujo uteroplacentario e isquemia (5).
Durante las semanas 15 y 20 de gestación, hay una remodelación de las arterias espiraladas y adquieren un fenotipo endotelial. Este proceso es conocido como pseudovasculogénesis y es regulado por el factor de crecimiento vascular endotelial (VEGF-A), angiopoyetinas y el factor de crecimiento placentario (PlGF).
El hecho de perder el control sobre el tono vascular lleva a HTA, aumento de la permeabilidad capilar con proteinuria y a una alteración de los factores de coagulación. La vasoconstricción y la isquemia también pueden llevar a una disfunción hepática.
2 - Aparición de una respuesta sistémica materna: La invasión y diferenciación del trofoblasto produce cambios en la expresión de ciertas citoquinas, sustancias de adhesión y moléculas de clase Ib de HLA. En las mujeres que van a desarrollar PE, la invasión endovascular citotrofoblástica es escasa y se produce una circulación fetoplacentaria defectuosa, que lleva a la isquemia placentaria.
Una vez que se llega al cuadro descripto, se produce una situación de progresiva hipoxia placentaria. Como consecuencia de esto, se elaboran factores solubles que se liberan a circulación y son los responsables de la disfunción endotelial sistémica materna que caracteriza a la PE.
Marcadores para la predicción de preeclampsia
La identificación de mujeres en riesgo es un propósito importante debido a la necesidad de realizar prevención primaria en las embarazadas. Un marcador que diferenciara a las mujeres con alto riesgo facilitaría la selección para estudios con potenciales agentes terapéuticos y diagnósticos más precisos.
Tradicionalmente, para el screening de PE, se identificaban los factores de riesgo maternos, historia clínica y características demográficas. De esta forma se reconocía solamente el 35% de PE en el primer trimestre, 40% de PE durante el segundo trimestre de gestación y un elevado porcentaje de falsos positivos y falsos negativos.
El marcador bioquímico ideal de PE debe jugar un papel central en la patogénesis de la enfermedad y ser específico de dicha condición. Asimismo tiene que ser detectable antes de la aparición de la clínica y ser fácilmente medible. Su sensibilidad y especificidad debe ser alta y sus niveles se deben correlacionar con la severidad de la enfermedad.
Hasta el momento no existe un único marcador bioquímico que cumpla dichos requisitos, lo que ha llevado al desarrollo de modelos matemáticos que combinan varios factores para incrementar la sensibilidad y especificidad en la predicción de PE.
Generalmente estos modelos combinan diversas variables, entre las que se incluyen varios marcadores bioquímicos medidos generalmente en el primer trimestre así como características maternas (médicas y obstétricas), marcadores ecográficos (estudio Doppler de la arteria uterina), y medida de la presión arterial, para incrementar su capacidad predictiva.
Recientemente Poon y Nikolaides han publicado un método de cribado con resultados muy prometedores. Este modelo incluye características maternas relacionadas con el desarrollo de preeclampsia, la medición de la presión arterial, el estudio Doppler de la arteria uterina en el primer trimestre y dos marcadores bioquímicos (PIGF y PAPP-A) medidos entre las 11° y 13° semanas de gestación (6).
Actualmente, The Fetal Medicine Foundation (FMF) (7) permite acceder a una estimación del riesgo de PE para cada uno de los estadios gestacionales. En el cálculo se incluyen factores maternos, historia clínica y mediciones biofísicas y bioquímicas.
Los marcadores útiles para el Primer trimestre (semana 11 a 14) son la Presión Arterial Media (MAP), el Índice de Pulsatilidad de la Arteria Uterina (UTPI) y dos marcadores bioquímicos: el Factor de Crecimiento Placentario (PlGF) y la Proteína A, asociada a embarazo (PAPP-A).Con esta combinación y en este período gestacional se detecta el 89% de PE (8,9).
La medición de los marcadores bioquímicos PlGF y PAPP-A, requiere de instrumentos y reactivos validados por The FMF y en la actualidad sólo hay 3 en el mercado: DelfiaXpress (PerkinElmer), Kryptor (ThermoFisher) y Elecsys (ROCHE).
El PlGF ejerce una serie de funciones durante la gestación, a nivel del desarrollo vascular de la placenta.
La vasculogénesis involucra la formación de novo de los vasos sanguíneos a partir de las células precursoras derivadas del mesodermo, mientras que la angiogénesis incluye la creación de nuevos vasos a partir de otros preexistentes. Ambos procesos son de importancia porque conllevan a un transporte efectivo de oxígeno y nutrientes al feto y a la placenta. El óptimo crecimiento de ambos depende de la formación de vasos materno fetales y del aumento de flujo sanguíneo en el lugar.
Los efectos de la hipoxia sobre el desarrollo placentario, el bienestar fetal y las complicaciones cardiovasculares tardías en la vida adulta son de considerable interés obstétrico e investigativo.
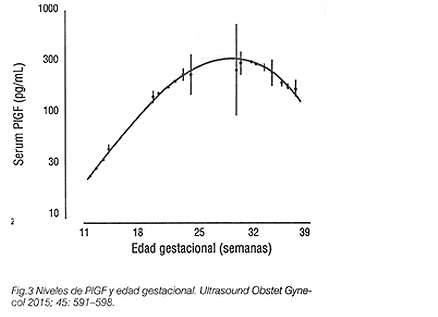
El PlGF promueve la viabilidad de las células endotelialies, tiene efecto quimiotáctico sobre los monocitos y actúa en los procesos angiogénicos. En un embarazo sin riesgo de PE, la concentración sérica de PlGF comienza a aumentar hasta alcanzar su máximo valor en las semanas 29 -32 y luego disminuye. Al inicio del trabajo de parto, los niveles plasmáticos comienzan a disminuir hasta su total desaparición tras éste.
Este marcador bioquímico es un excelente predictor de PE en el primer trimestre de gestación y debería ser incluido en el screening. Las pacientes con PE tienen valores menores de PlGF que las que no desarrollan la enfermedad (10). La prevención en este momento del embarazo es fundamental porque con medidas de control de las arterias uterinas y aspirina se reduce significativamente la probabilidad de desarrollar PE durante el embarazo y con ello los riesgos maternos y neonatales.
Conclusión
La PE es una complicación sistémica que afecta alrededor del 10% de las mujeres embarazadas y es causa de una alta tasa de morbimortalidad. En la actualidad, la combinación de dos o más marcadores bioquímicos, con los factores maternos y el Doppler de arterias uterinas mejora notablemente la especificidad y sensibilidad del cribado.
Los marcadores bioquímicos ofrecen una detección temprana de la patología, por lo que es necesario que el marcador ideal tenga una sensibilidad y especificidad apropiadas, permita dilucidar el mecanismo fisiopatológico, se correlacione con la severidad de la preeclampsia antes de su aparición y tenga una baja tasa de falsos positivos, menor al 5% de acuerdo a la Organización Mundial de la Salud.
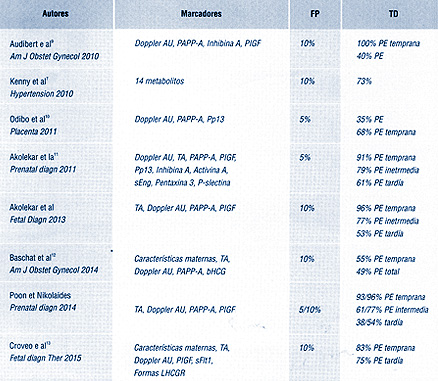
• Tabla 1. Modelos de predicción de preeclampsia
Referencias bibliográficas
1. Sibai BM: Diagnosis and management of gestational hypertension and preeclampsia. Obstet Gynecol 2003; 102: 181-92.
2. Barker D. The Developmental Origins of Chronic Adult Disease. Acta Paediatrica Suppl. 2004; 93: 26-33.
3. Cuckle HS, Wald N. Tests using single markers. In Antenatal and Neonatal Screening, 2nd edition. Wald N, Leck I (eds). Oxford University Press: Oxford: 2000; pp 3–22.
4. Harrington K, Goldfrad C, Carpenter RG, Campbell S. Transvaginal Uterine and Umbilical Artery Doppler examination at 12–16 weeks and the subsequent development of Preeclampsia and Intrauterine Growth Retardation. Ultrasound Obstet Gynecol. 1997; 9: 94–100.
5. Furuya M, Kurasawa K, Nagahama K, Kawachi K, Nozawa A, Takahashi T, Auki I. Disrupted balance of angiogenic and antiangiogenic signalings in preeclampsia. J Pregn. 2011; 1-10.
6. Poon LC, Nicolaides KH. First-trimester maternal factors and biomarker screening for preeclampsia. Prenat Diagn. 2014; 34: 618-27.
7. The Fetal Medicine Foundation. https://fetalmedicine.org
8. Competing risks model in screening for preeclampsia by maternal characteristics and medical history David Wright, PhD; Argyro Syngelaki, RM; Ranjit Akolekar, MD; Leoena C. Poon, MD; Kypros H. Nicolaides, MD.
9. Competing risks model in screening for preeclampsia by maternal factors and biomarkers at 11-13 weeks gestation Neil O'Gorman, MD; David Wright, PhD; Argyro Syngelaki, RM; Ranjit Akolekar, MD; Alan Wright, PhD; Leona C. Poon, MD; Kypros H. Nicolaides, MD.
10. Serum placental growth factor in the three trimesters of pregnancy: effects of maternal characteristics and medical history. Tsiakkas; Duvdevani, A; WRIGHT,A†; , Wright, D† and NICOLAIDES, KH. Ultrasound Obstet Gynecol 2015; 45: 591–8.
|
|