Pruebas para identificar Cryptococcus neoformans
Microscopía rápida y el uso de colorantes vitales: nueva prueba para determinar la viabilidad de Cryptococcus neoformans en el Laboratorio Clínico. PLoS One. 2015 Jan 27; 10(1):e0117186. McMullan BJ, Desmarini D, Djordjevic JT, Chen SC, Roper M, Sorrell TC.. |
Resumen
Antecedentes: El Cryptococcus neoformans es la causa más común de la meningitis fúngica, con una mortalidad sustancial a pesar del tratamiento adecuado. El cultivo cuantitativo de Cryptococcus en el líquido cefalorraquídeo (LCR) durante la terapia antifúngica es de valor pronóstico y tiene implicancias terapéuticas, pero es lento y no es practicable en muchos países de bajos recursos.
Métodos: Pusimos a prueba dos técnicas rápidas para cuantificar criptococos viables usando mezclas de criptococos cultivadas in vitro, vivos y muertos por calor: (i) la microscopía cuantitativa con tinción de exclusión utilizando colorante azul tripan, y (ii) la citometría de flujo, usando el colorante fluorescente 2' - 7' – Bis - (2 - carboxietil) - 5- (6) carboxifluoresceína, éster de acetoximetilo (BCECF-AM). Los resultados se compararon con los cultivos estándar de criptococos cuantitativos. La microscopía cuantitativa también se realizó en muestras de líquido cefalorraquídeo (LCR).
Resultados: Tanto la microscopía y como la citometría de flujo distinguieron entre criptococos viables y no viables. El recuento de células (en escala logarítmica) por microscopía y por cultivo cuantitativo, mostraron una asociación lineal significativa (p <0,0001) y el análisis de Bland-Altman mostró un alto nivel de acuerdo. Las proporciones de células viables (en escala logit), detectadas por citometría de flujo fueron lineal y significativamente asociadas con las proporciones detectadas por microscopía (p <0,0001) y el análisis de Bland-Altman mostró un alto nivel de acuerdo.
Conclusiones: El examen microscópico directo del Cryptococcus teñido con azul tripan y la evaluación por citometría de flujo del Cryptococcus teñido con BCECF-AM mostraron una buena concordancia con los cultivos cuantitativos. Estas son estrategias prometedoras para la determinación rápida de la viabilidad de criptococos, y deben ser investigados en la práctica clínica.
Bibliografía
En inglés
1. Chaka W, Scharringa J, Verheul AF, Verhoef J, Van Strijp AG, Hoepelman IM. Quantitative analysis of phagocytosis and killing of Cryptococcus neoformans by human peripheral blood mononuclear cells by flow cytometry. Clin Diagn Lab Immunol. 1995; 2(6):753-9.
2. Bauters TG, Swinne D, Stove V, Nelis HJ. Detection of single cells of Cryptococcus neoformans in clinical samples by solid-phase cytometry. J Clin Microbiol. 2003; 41(4):1736-7.
3. Kummrow A, Frankowski M, Bock N, Werner C, Dziekan T, Neukammer J. Quantitative assessment of cell viability based on flow cytometry and microscopy. Cytometry A. 2013; 83(2):197-204.
4. Hernlem B, Hua SS. Dual fluorochrome flow cytometric assessment of yeast viability. Curr Microbiol.
2010; 61(1):57-63.
5. Alanio A, Vernel-Pauillac F, Sturny-Leclère A, Dromer F. Cryptococcus neoformans host adaptation: toward biological evidence of dormancy. MBio. 2015; 6(2): e02580-14.
6. Xu S, Mutharasan R. Cell viability measurement using 2',7'-bis-(2-carboxyethyl)-5-(and-6)-carboxyfluorescein acetoxymethyl ester and a cantilever sensor. Anal Chem. 2011; 83(4):1480-3.
En español
1: López-Jácome LE, Hernández-Durán M, Colín-Castro CA, Ortega-Peña S, Cerón-González G, Franco-Cendejas R. Las tinciones básicas en el laboratorio de microbiología. Investigación en Discapacidad. 2014; 3(1):10-8.
2: Quian J, Gutiérrez S, González V, Sánchez M, Abayian M, Baccino F. Meningitis por Cryptococcus neoformans en niños y adolescentes infectados por virus de la inmunodeficiencia humana. Rev Chilena Infectol 2012; 29 (5): 554-557.
3: Cattana ME, Tracogna MF, Fernández MS, Rey MC, Sosa MA, Giusiano GE. Genotipificación de aislamientos clínicos del complejo Cryptococcus neoformans/Cryptococcus gattii obtenidos en el Hospital «Dr. Julio C. Perrando», de la ciudad de Resistencia (Chaco, Argentina). Revista Argentina de Microbiología. 2013; 45(2):89-92.
4: Cabello Úbeda A, Fortes Alen J, Gadea I, Mahillo I, Górgolas M, Fernández Guerrero ML. Meningoencefalitis criptocócica. Epidemiología y factores de riesgo de mortalidad en la era pre- y pos-TARGA. Medicina Clínica. 2016; 146(9):397-401.
 Agudice su ingenio Agudice su ingenio
Actividad Interactiva
Lo invitamos a observar las siguientes imágenes y completar el fragmento que se encuentra debajo con las opciones correspondientes:
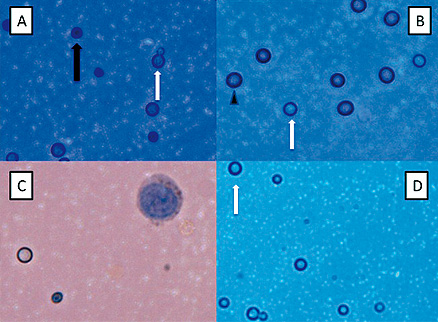
Microscopia con azul de tripan de Cryptococcus
El estudio histopatológico (microscopio óptico) del Cryptococcus teñido con azul de tripan a un aumento de 40x distingue fácilmente Cryptococcus viables (transparente, flecha blanca) y muertos (azul oscuro, flecha negro) in Vitro *......... y en muestras de LCR *.........
Los eritrocitos (punta de flecha) se observan también en la muestra de LCR en *......... junto con criptococos viables.*......... son muestras de LCR obtenidos antes y después de ser diluidos con agua, respectivamente, lo que lisa las células de mamíferos. La gran célula nucleada (ver imagen) observada antes de la dilución en *......... es un leucocito.
Muchos criptococos viables permanecen en el LCR después de la lisis de células de mamífero en *......... (flecha blanca). La diferente intensidad de color de fondo es debido al ajuste de la iluminación de la microscopía, el enfoque y el contraste. Ningún ajuste de color se realizó después de la fotografía.
Información complementaria
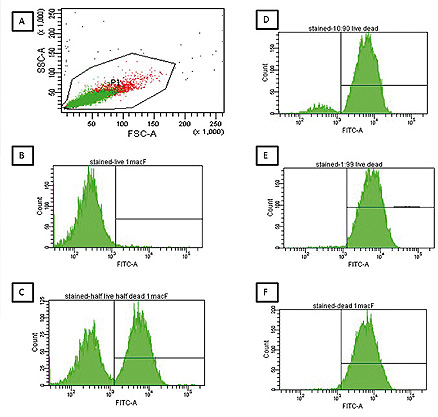
Evaluación con citometría de flujo de criptococos viables usando BCECF.
Criptococos viables y muertos por calor se mezclaron para producir las siguientes proporciones de células vivas: células muertas (100: 0,50:50, 10:90, 1:99, 0: 100) en una dilución de 1 McFarland y se tiñeron con BCECF. Los diagramas de dispersión muestran mezclas representativas en una dilución de 1 McFarland, con el "gate" que contiene células vivas y muertas.
* Elija la/s letra/s de imagen/es correspondiente/s.
Consulte nuestros servicios
- Asesoría profesional en metodología de la investigación.
- Biblioteca.
- Taller documental (manuscritos, pósters y resúmenes de congresos, CV, presentaciones orales).
- Capacitación en estos temas.
web: http://www.faba.org.ar
Jefe Responsable del Sector: Dra. Nilda Fink
Atención al público: Susana Feregotto, Pamela De Francesco
Horarios de Atención: de Lunes a viernes de 9 a 20 hs.
E- mail: bibliote@fbpba.org.ar
|
|


