Microbiología
Un hallazgo clave
contra la resistencia bacteriana
Una investigación hecha por científicos argentinos, y que es tapa de la edición de enero de la revista Molecular Microbiology, podría ser la clave para desarrollar nuevas formulaciones terapéuticas eficaces contra infecciones hasta ahora resistentes a los antibióticos

• Diferentes tipos de biofilms bacterianos sólidos
Por Ana María Pertierra
Un grupo de bioquímicos y biotecnólogos de la Facultad de Bioquímica y Farmacia de la Universidad Nacional de Rosario descubrieron cuál es el mecanismo por el cual ciertas bacterias desarrollan resistencia a los agentes antimicrobianos a través de la formación de esporas o de biofilms. El trabajo, que acaban de publicar en la revista de mayor relevancia en la especialidad, es una investigación de ciencia básica con una gran potencialidad para su aplicación en la práctica clínica.
El modelo de estudio presentado fue hecho con Bacillus subtilis, un paradigma de bacteria Gram positiva formadora de esporas que no es patógena. Sin embargo, los resultados obtenidos con esta bacteria también se dan en ciertos patógenos humanos como Clostridium perfringens, bacteria causante de la gangrena y de cierto tipo de diarreas, Bacillus anthracis, causante del ántrax, Bacillus cereus, contaminante de alimentos y causante de diarreas, Clostridium difficile, que produce diarreas asociadas al uso de antibióticos, Clostridium botulinum, causante del botulismo y Clostridium tetani, causante del Tétano.
El estudio revela la función clave de una proteína, llamada Spo0A, que actúa como reguladora del mecanismo mediante el cual las bacterias forman esporas o biofilms, estructuras que les permiten resistir a la acción de agentes antibióticos.
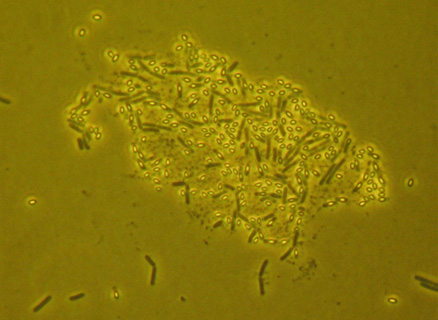
• Esporas refráctiles y resistentes de Bacillus subtilis
FABA-INFORMA entrevistó al doctor Roberto Grau, bioquímico que lideró al equipo de jóvenes investigadores, quien explicó detalles y alcances de este trabajo de biología molecular que les demandó más de dos años de experimentos. En una comunicación telefónica desde la ciudad de Rosario Grau puntualizó: “Lo que nosotros encontramos es que esta proteína ,Spo0A , es el regulador maestro del remodelado de la membrana celular y de la síntesis de la nueva membrana tanto de la espora como de la formación de biofilm”.
Según Grau, “hasta ahora se sabía que esta proteína, Spo0A, que está presente en bacterias Gram positivas formadoras de esporas tanto del género Bacillus como Clostridium, era el regulador maestro de la esporulación. Nosotros encontramos que esta proteína también regula la síntesis de los lípidos que van a formar parte de la membrana celular de la bacteria, ya sea cuando está esporulando como cuando forma un biofilm. Con el agregado de que cuando se forma un biofilm, esos lípidos constituyen la matriz extracelular es decir, esa sustancia pegajosa que mantiene juntas a las células y las hace trabajar como una comunidad”.

• De izq. a der: Lic. Cecilia Leñini, Lic. Paula de Oña y Dr. Roberto Grau
El descubrimiento de los científicos rosarinos allana el camino hacia el desarrollo de agentes terapéuticos nuevos que se propongan inhibir ese mecanismo de síntesis lipídica para desbaratar la formación de estas formas de resistencia bacteriana.
Si bien no todas las bacterias son capaces de formar esporas, la mayoría pueden formar biofilms, estructuras en las que pueden agruparse millones de células bacterianas y que constituyen verdaderas fortalezas para las bacterias patógenas donde se organizan y se protegen del ataque del sistema inmunológico y de los antibióticos.
“En un biofilm, las bacterias tienen un comportamiento pluricelular –explica Grau– porque aún siendo todas las células idénticas, al estar asociadas están ocupando determinados lugares en una organización espacio-temporal que les permite comunicarse entre sí, lograr una mejor utilización de los nutrientes y adaptarse al medio ambiente para sobrevivir. En el caso de una infección, la capacidad de las bacterias de formar un biofilm les permite sobrellevar la acción de los antibióticos”.
Según el especialista esta situación obedecería a dos causas: que el antibiótico no resulta permeable en la estructura del biofilm y por lo tanto no alcanza a las bacterias ; y que las bacterias organizadas en el interior del biofilm tendrían un metabolismo diferente sobre el cual los antibióticos no resultarían eficaces.
“Por lo general, los antibióticos están desarrollados para atacar la actividad metabólica de los gérmenes que se encuentran en estado libre, o planctónico, pero uno de los grandes targets de la industria farmacéutica actual es desarrollar nuevos tipos de antibióticos que interfieran con la formación del biofilm”, explicó el bioquímico.
Es por eso que la aplicabilidad de los hallazgos de los científicos de la UNR (y del CONICET) sería un gran aporte para desarrollar inhibidores de la actividad de la proteína Spo0A y de ese modo impedir no solo la formación de esporas sino también la producción de los lípidos necesarios para el ensamblado de la matriz extracelular del biofilm y así las bacterias quedarían indefensas. La gran ventaja –puntualiza Grau– es que esta estrategia terapéutica no solo podría aplicarse selectivamente a bacterias Gram positivas formadoras de espora sino para todas las bacterias capaces de generar biofilm, esporulen o no, sean Gram positivas o Gram negativas, inclusive eficaces contra micobacterias causantes de la Tuberculosis.
En cuanto a la repercusión que está teniendo este trabajo de investigación, Grau destacó orgulloso: “Es un trabajo 100% argentino, tiene mucho interés desde la investigación básica pero además por la aplicabilidad que puede llegar a tener”.
Los experimentos determinantes para arribar a los resultados publicados se llevaron a cabo durante los dos últimos años, pero el tema apasiona a Grau desde hace más de 20 mientras elaboraba su tesis doctoral: “En 1993, en la época de mi tesis doctoral, en función de ciertos resultados tuve los primeros indicios de que esta proteína estaba regulando la síntesis de lípidos. Hace dos años empezamos a hacer experimentos de biología molecular con los que pudimos demostrar este mecanismo”.
Grau que es doctor en bioquímica por la UNR, profesor adjunto en el Departamento de Microbiología de la Facultad de Bioquímica y Farmacia de dicha alta casa de estudios e investigador independiente del Conicet, lideró el equipo de investigación integrado por María Eugenia Pedrido, Paula de Oña, Walter Ramírez, y Cecilia Leñini, todos biotecnólogos con becas doctorales de Conicet y Foncyt, además del doctor Aníbal Goñi también del CONICET.
Un ecosistema microbiano organizado
Una biopelícula o biofilm es un ecosistema microbiano organizado, formado por varios microorganismos asociados a una superficie viva o inerte y que tiene características funcionales y estructuras complejas. Se produce cuando las células planctónicas se adhieren a una superficie o sustrato, formando una comunidad, que sintetizando y secretando diferente tipos de sustancias como proteínas, exopolisacáridos y lípidos forman una matriz extracelular adhesiva y protectora.
“La proteína Spo0A es un regulador transcripcional que activa la expresión de los genes que están involucrados en la formación de esporas y biofilms. Se la llama master regulator porque comanda muchos otros reguladores y está involucrada en el comportamiento social de las bacterias que las lleva a la formación del biofilm además de otras respuestas como ser canibalismo, movilidad sobre superficies (gliding, swarming, sliding), producción de toxinas, etc.”, explicó Grau.
Las bacterias así asociadas ocupan distintas posiciones y se conectan entre sí mediante un mecanismo de comunicación celular llamado quorum sensing, mediante el cual los gérmenes liberan pequeñas moléculas que, a modo de hormonas, actúan a distancia como señales químicas que regulan la expresión de genes de manera diferente en las distintas partes de la comunidad bacteriana.
Ese tipo de biofilm se puede formar en el organismo humano en diferentes mucosas como en la mucosa intestinal, la de las vías respiratorias, y en la vaginal, por ejemplo.
Estos biofilms o biopelículas están asociadas a la naturaleza crónica de ciertas infecciones como las que se presentan en los pacientes con fibrosis quística. “Las personas con fibrosis quística están muy predispuestas a padecer infecciones pulmonares causadas sobre todo por Pseudomona aeuruginosa, un patógeno oportunista que tiene gran facilidad de formar biofilms en la zona de los alvéolos pulmonares donde la terapia antibiótica no resulta eficaz y esto lleva a la muerte del paciente por la insuficiencia respiratoria de la enfermedad y por la infección”, explicó Grau.
En la mucosa vaginal entre las bacterias patógenas capaces de formar estos biofilm se encuentran las del género Neisseria, Clamidia, entre otras. Y a nivel intestinal, una de las más peligrosas para la salud humana es la Escherichia coli enterohemorrágica cuya complicación en la población pediátrica es el síndrome urémico hemolítico. “La Escherichia coli ingresa al organismo mediante algún alimento contaminado (en general, carne picada mal cocida), llega al intestino, se adhiere a la mucosa y forma un biofim y desde allí segrega toxinas que pasan al torrente circulatorio y que actúan a distancia produciendo el daño renal del síndrome urémico hemolítico”.
Además los biofilms representan una amenaza clínica ya que son capaces de producirse en elementos inertes como catéteres e implementos médicos y quirúrgicos así como en los sistemas de purificación de aguas y de ventilación.
Un mecanismo de resistencia extrema
“Hay bacterias que esporulan y pueden formar biofilm, es el caso del género Clostridium y Bacillus, pero muchas bacterias son capaces de formar biofilm pero no esporas”, señaló Grau y aclaró “la formación de esporas es un mecanismo de resistencia extrema, hay reportes científicos que señalan que los esporos pueden sobrevivir millones de años permaneciendo en estado de latencia”.
Las esporas se encuentran por todas partes y pueden estar presentes en la piel, y en el intestino de individuos sanos porque el sistema inmunológico las mantiene a raya y no encuentran el medio propicio para desarrollar. Sin embargo, ya sea porque el sistema inmunológico fracasa o se deteriora o por estar frente a una alta dosis de patógenos los individuos enferman y se debe recurrir al uso de antibióticos para controlar la infección.
Los esporos de Clostridium perfringens constituyen una amenaza para los pacientes diabéticos que son susceptibles por su enfermedad a tener microlesiones en las extremidades en la cuales pueden introducirse esporos del medioambiente que desarrollando en un medio anaeróbico producen la peor complicación del pie diabético, la gangrena.
“Ante la complicación de la gangrena no hay antibiótico que valga –enfatiza Grau– es una infección que avanza 10cm por hora en su estado activo y aunque el tratamiento antibiótico ataque a la bacteria, las toxinas siguen actuando y dañando el tejido por eso muchas veces se termina en una amputación”, sostuvo el científico.
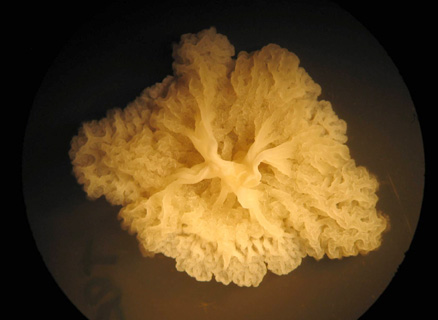
• Diferentes tipos de biofilms bacterianos sólidos
Todas las bacterias patógenas productoras de esporas representan un problema serio para la industria de los alimentos. Gérmenes como Clostridium botulinum o Bacillus cereus son ejemplos de contaminantes de alto riesgo. “Cada vez se desarrollan más alimentos deshidratados para evitar la cadena de frío pero en esos casos las esporas sobreviven a los métodos de pasteurización”, concluyó Grau.
|
|