TROMBOSIS: conocerla para evitarla
El Comité de Redacción de Acta Bioquímica Clínica Latinoamericana ha seleccionado este artículo publicado en INDUSTRIA Y QUÍMICA - Número 357 - Mayo 2008, para su difusión a través de FABA Informa

I.L. Quintana, A.M. Lauricella, M.M. Castañon, V. Genoud,
B. Sassetti, L.C. Kordich*
Laboratorio de Hemostasia y Trombosis.
Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires.
Iht@qb.fcen.uba.ar
El interés de la ciencia se ha basado en proveer el bienestar del hombre. En este sentido, la prolongación de la vida y el estado de salud han sido motivos de preocupación que han impulsado a la investigación hacia la prevención y el tratamiento de las enfermedades.
Una de las principales causas de morbi-mortalidad en el mundo moderno la constituyen las enfermedades vasculares oclusivas, tales como la aterosclerosis y la trombosis, causas principales de la enfermedad cardiovascular.
A medida que aumenta la expectativa de vida del hombre, mayor es la responsabilidad de los eventos vasculares oclusivos en causar su muerte o discapacitarlo. Por lo tanto, es muy importante y necesario establecer medidas de prevención adecuadas, métodos de diagnóstico y una terapéutica eficiente. Para llevar a cabo estos objetivos es prioritario conocer los mecanismos fisiopatológicos que conllevan a la enfermedad y establecer los factores de riesgo asociados a la misma. Precisamente, éstos han sido puntos de interés del Laboratorio de Hemostasia y Trombosis, desde de su formación en la Facultad de Ciencias Exactas y Naturales.
La hemostasia es un proceso que involucra diversos mecanismos que tienen como función mantener la fluidez de la sangre y la integridad vascular. Es así que cuando ocurre una lesión en un vaso sanguíneo el sistema hemostático es el responsable de evitar una hemorragia excesiva. En realidad, el primer mecanismo que se pone en marcha es el de la vasoconstricción y simultáneamente se inician una serie de procesos que conducen a la formación del tapón hemostático, constituido por el tapón plaquetario y por el coágulo de fibrina, localizado en el sitio de la lesión. El sistema hemostático no sólo provee los mecanismos para formar el coágulo sino que, además, controla y limita la extensión del mismo. Una vez detenida la pérdida de sangre, el sistema también regula los procesos responsables de la reparación del vaso dañado y la posterior disolución de los depósitos intravasculares de fibrina, para lograr la recuperación de la integridad vascular. Para llevar a cabo esta función tan compleja, intervienen diversos componentes interrelacionados tales como: la pared vascular, las plaquetas, el sistema de coagulación, el sistema fibrinolítico y los inhibidores fisiológicos tanto de la coagulación como de la fibrinolisis. Además, en la función hemostática también intervienen, indirectamente, otros sistemas enzimáticos (tales como el sistema complemento, calicreínas-quininas y renina-angiotensina), factores reológicos (como velocidad y viscosidad de la sangre) y células sanguíneas (leucocitos y eritocitos). Cuando existen alteraciones cuali o cuantitativas de alguno o de varios de los factores mencionados, puede modificarse el delicado equilibrio de la hemostasia y producirse eventos extremos y contrapuestos como son la hemorragia y la trombosis. Esta última ha sido el objetivo general del trabajo de investigación de nuestro laboratorio.
Actualmente la trombosis es considerada una patología multicausal resultante del efecto de factores genéticos y adquiridos que interactúan entre sí. Se ha avanzado notablemente en el conocimiento de este tema, pero en algunos casos aún no puede explicarse la patogénesis del episodio trombótico. En la investigación de condiciones asociadas a un incremento de la enfermedad aterotrombótica se describieron factores predisponentes tales como dislipidemia, hipertensión, diabetes, tabaquismo, obesidad, stress, alteraciones en los sistemas de coagulación y fibrinolítico, etc.
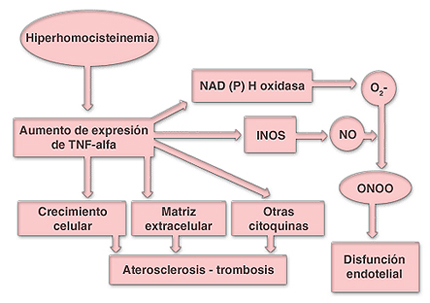
A partir de la década del ‘90 se realizaron importantes estudios epidemiológicos a nivel internacional, que establecieron que niveles elevados de homocisteína en la circulación sanguínea (hiperhomocisteinemia) constituyen un factor de riesgo independiente para la enfermedad aterotrombótica, y en particular para la enfermedad cardio y cerebrovascular [1, 2]. Sin embargo, aún existen discrepancias al respecto, ya que algunos investigadores cuestionan esa afirmación y plantean que la hiperhomocisteinemia no sería el agente responsable del riesgo cardiovascular, sino un marcador asociado a dicho riesgo. Con el fin de dilucidar esta disyuntiva, están en curso estudios clínicos prospectivos y randomizados de intervención terapéutica (ácido fólico combinado con vitamina B12 y/o vitamina B6) para evaluar si el descenso de los niveles plasmáticos de homocisteína disminuyen el riesgo de enfermedad cardiovascular.
La homocisteína es un aminoácido, producto intermediario del metabolismo de la metionina, que no forma parte de proteínas naturales. Cuando el metabolismo de la homocisteína se encuentra alterado la concentración intracelular de la misma es potencialmente tóxica y el aminoácido es exportado fuera de la célula y pasa a circulación. Aún no hay consenso internacional para establecer valores de referencia para la concentración de homocisteína plasmática, aunque la mayoría de los estudios proponen que los niveles de homocisteína superiores a 12 ?M se asocian con un aumento significativo del riesgo de enfermedad cardiovascular [3, 4].
Con el objeto de dilucidar los mecanismos fisiopatológicos involucrados en la acción perjudicial de la homocisteína, diversos grupos de investigación han realizado experiencias in vitro, ex vivo y en modelos animales. Se ha postulado que la homocisteína podría incrementar el estrés oxidativo (por la generación de peróxido de hidrógeno, radicales hidroxilos y superóxidos), limitar la biodisponibilidad de óxido nítrico, estimular la proliferación de células de músculo liso, alterar las propiedades elásticas de la pared vascular, etc. Estos hallazgos sugieren que los niveles aumentados de homocisteína provocarían disfunción endotelial, con la consecuente activación plaquetaria y de los sistemas de coagulación, fibrinolisis y sus inhibidores fisiológicos [5]. Sin embargo, los mecanismos involucrados aún no están totalmente esclarecidos.
Conocer los diversos aspectos de los problemas de salud resultantes de la hiperhomocisteinemia ayudará a la prevención de los mismos. En este sentido es importante la actualización del tema y su difusión tanto a nivel científico como de divulgación general. Principalmente deben darse a conocer las respuestas a los siguientes interrogantes: ¿cómo prevenir la hiperhomocisteinemia?, ¿cómo y dónde diagnosticarla? y ¿cuál es el tratamiento adecuado? Ante la importancia del tema y el planteo de numerosos interrogantes sin resolver, es que nuestro grupo de laboratorio emprendió una línea de investigación en el área abarcando diversos aspectos, destacándose a continuación los principales resultados.
Inicialmente, fue prioritario disponer de un método analítico accesible y confiable para evaluar los niveles de homocisteína en diversos grupos poblacionales. Con este fin se realizó la validación de una técnica de ELISA (Enzyme Lynked Immuno Sorbent Assay) que, si bien se disponía comercialmente, no existían reportes internacionales que avalaran sus resultados. El estudio demostró que esta técnica permite determinar la concentración de homocisteína plasmática, obteniendo resultados
reproducibles, confiables y equivalentes a los determinados por el método de referencia (HPLC: High Performance Liquid Chromatography) [6].
Disponiendo de la metodología de evaluación de homocisteína se analizó la concentración plasmática de homocisteína en la población sana de Buenos Aires. Losresultados mostraron que para la población entre 3 y 59 años los valores de homocisteinemia están comprendidos entre 5,0 y 19,2 ?M. El análisis en grupos etáreos extremos mostró que para los neonatos los valores resultaron entre 1,2 y 11,6 ?M, mientras que para sujetos mayores de 60 años fueron entre 6,0 y 30,0 ?M. Estos resultados, sin embargo, no deben considerarse como valores de referencia, teniendo en cuenta que los datos obtenidos revelan una elevada prevalencia de hiperhomocisteinemia y sugieren deficiencias vitamínicas subclínicas (vitamina B12 y de ácido fólico), probablemente asociadas a los hábitos alimentarios de nuestra población. Además, se demostró que la homocisteinemia aumenta con la edad y es mayor en los hombres que en las mujeres [7, 8].
Como se ha comentado, la homocisteinemia es la resultante del efecto directo y de la interacción de factores genéticos y adquiridos. Pacientes con restricción de ingesta de vegetales verdes (con alto contenido de folatos), evidenciaron un déficit importante de ácido fólico intraeritrocitario y un aumento significativo en los niveles de homocisteína respecto a los individuos sin restricción dietaria [9]. Además, se demostró que la ingesta de una dieta que aporte 400 ?g de ácido fólico por día, disminuye significativamente los niveles de homocisteína plasmática [10].
Respecto al efecto de alteraciones genéticas sobre la homocisteinemia se estudió el polimorfismo C677T de la metilentetrahidrofolato reductasa (MTHFR). La prevalencia del polimorfismo de la MTHFR en la población de la República Argentina resultó CC 41,4%; CT 42,8% y TT 15,8% [11]. Por otro lado, se observó que lo niveles
de homocisteína aumentarían sólo cuando la mutación está presente en individuos homocigotas, aunque la presencia de esta variante termolábil no resultó factor de riesgo independiente para la trombosis venosa, ni aún en homocigosis.
Por lo tanto, determinar homocisteinemia permite detectar la presencia de un factor de riesgo aterotrombótico y probables deficiencias vitamínicas, mientras que la identificación del genotipo homocigota para la MTHFR advierte acerca de un factor genético condicionante de hiperhomocisteinemia [12].
Teniendo en cuenta que el riesgo de enfermedad vascular aumenta gradualmente con el incremento de los niveles plasmáticos de homocisteína sin observarse un claro valor umbral, y que la hiperhomocisteinemia es altamente prevalente en la población general, es importante establecer un valor de referencia. El límite superior considerado inicialmente fue 15 ?M, pero en base a numerosos estudios epidemiológicos en poblaciones sanas, se han propuesto valores menores. Para establecer un valor de corte de homocisteinemia, realizamos un estudio caso-control en pacientes con trombosis venosa e individuos sanos. Basados en nuestros resultados, determinamos que la hiperhomocisteinemia constituye un factor de riesgo independiente para la trombosis venosa, siendo el riesgo trombótico asociado mayor en hombres que en mujeres, proponiendo un valor de corte de 12 ?M [13].
Se investigaron los posibles efectos que la homocisteína podría ejercer sobre diversos componentes del sistema hemostático en experiencias in vitro y ex vivo. En presencia de homocisteína se obtuvieron redes de fibrina, compactas, con fibras cortas, gruesas y muy ramificadas. El grupo tiol de la homocisteína estaría involucrado en estos efectos [14]. Además, las redes de fibrina obtenidas en presencia de homocisteína resultaron más resistentes a la lisis con u-PA (activador del plasminógeno de tipo urinario) [15]. La permanencia prolongada de la fibrina en el compartimiento vascular favorecería el desarrollo de eventos trombóticos.
Consideramos que los resultados de nuestros trabajos pueden contribuir al esclarecimiento de algunos de los mecanismos responsables de la relación de la hiperhomocisteinemia con la enfermedad vascular. En la medida que se conozca el verdadero rol de la hiperhomocisteinemia se justificará la implementación de su diagnóstico y tratamiento. Cabe destacar que la terapeútica para disminuir los niveles de homocisteína es sencilla, económica y segura. Consiste en la suplementación vitamínica con ácido fólico, vitamina B12 y/o vitamina B6.
Si se demuestra que el descenso de la concentración plasmática de homocisteína reduce el riesgo cardiovascular, el impacto potencial para la salud pública sería muy importante considerando la alta incidencia de las enfermedades cardiovasculares en las sociedades actuales. Por lo tanto, el conocimiento en el sentido más amplio, de los factores de riesgo asociados a la enfermedad vascular oclusiva, permitirá implementar medidas de prevención para disminuir la morbi-mortalidad de la población, con el consecuente beneficio socioeconómico para la comunidad.
Referencia bibliograficas
[1] M.R. Malinow, S.S. Kang, L.M. Taylor, et al. Circulation. 1989, 79, 1180-1188.
[2] A. D' Angelo, J. Selhub. Blood. 1997, 90, 1-11.
[3] J. Ubbink, P. Becker, W.J. Hayward Vermaak, R. Delport. Clin Chem. 1995, 41(7), 1033-1037.
[4] K. Rasmussen, J. Moller, M. Lyngbak, A. Pedersen, L. Dybkjaer. C/in Chem.1996, 42(4), 630-636.
[5] A. Coppola, G. Davi, V. De Stefano, F.P. Mancini, A.M. Cerbone, G. Di Minno. Semin Thromb Hemost. 2000, 26(3), 243-254.
[6] I. Quintana, D. Freeman, C. Galarza, A. Murúa, J. Spence, L. Kordich. Blood Coagul Fibrinolysis. 2000, 11, 235-238.
[7] I. Quintana, M. Castañon, A. Murúa, L. Kordich. Hematología. 2002, 6(1), 2-7.
[8] J. Janson, A. Murúa, I. Quintana, C. Galarza, P. Pzygoda, G. Waisman, L. Cámera, M. O'Flaherty, L. Kordich, M. Morales, M. Cámera. Am J Hypertension. 2002, 15(5), 394-397.
[9] A. Murúa, I. Quintana, C. Galarza, J. Alfje, L. Kordich. Blood Coagul Fibrinolysis. 2001, 12, 79-80.
[10] A. Murúa, I. Quintana, J. Janson, M. Batista, M. Cámera, L. Kordich. Thromb Res. 2000, 100(6), 495-500.
[11] V. Genoud, M. Castanon, J. Annichino-Bizzacchi, J. Korin, L. Kordich. Thromb Res. 2000, 100(3), 127-131.
[12] M. Castañon, A. Lauricella, V. Genoud, I. Quintana. Acta Bioquim Clín Latinoam. 2006, 40(3), 335-339.
[13] M. Castañon, A. Lauricella, L. Kordich, I. Quintana. Clin Chem Lab Med. 2007, 45(2), 232-236.
[14] A. Lauricella, I. Quintana, L. Kordich. Thromb Res. 2002, 107, 75-79.
[15] A. Lauricella, I. Quintana, M. Castañon, B. Sassetti, L. Kordich. Blood Coagul Fibrinolysis. 2006, 17, 181-186.
|
|


