Relación entre las Funciones
Hipotálamo-Hipofiso-Adrenal (HHA) y Adipocitaria
El Comité de Redacción de Acta Bioquímica Clínica Latinoamericana ha seleccionado este artículo publicado en INFORME ALAC, Año XIII - Nº 1 – 2008, para su difusión a través de FABA Informa.
Eduardo J. Spinedi
Unidad de Neuroendocrinología, Instituto Multidisciplinario de Biología Celular, La Plata
(CONICET -CICPBA) CC 403, 1900 La Plata TE/FAX: (0221) 421-0112
spinedi@imbice.org.ar
 Figura 1. Adipocitos uniloculares de Figura 1. Adipocitos uniloculares de
TA retro-peritoneal normal
(tamaño aproximado 150 mm2; Obj. x 25)
 Figura 2. Adipocitos uniloculares de Figura 2. Adipocitos uniloculares de
TAB retro-peritoneal obeso
(mayor tamaño, aproximado 400 mm2; Obj. x 25)
1 -Estructura y Función Endocrina del Tejido Adiposo (TA)
El tejido adiposo blanco fue considerado durante varias décadas como un simple órgano de reserva energética. Sin embargo, fundamentalmente durante la última década, numerosos estudios sobre balance energético han originado amplia información sobre las actividades funcionales del adipocito, lo que llevó a integrarlo dentro del sistema de órganos endocrinos. Más aún, los resultados de diversos estudios lo posicionan como sistema endocrino de relevante importancia en el mantenimiento homeostático del medio interno del organismo.
Los tejidos adiposos se pueden clasificar, de manera simple, como blanco (TAB) y pardo (TAP). Esta clasificación emerge de la localización anatómica, la estructura morfológica, sus funciones y regulación.
Ambos son adiposos dada la cantidad de lípido que almacenan. El pardo es denominado así por su aspecto de color, dada la abundante vascularización y contenido de citocromos. Ambos contienen elevada reserva energética debido a la abundante cantidad de triglicéridos.
Aunque el TAB libera energía de acuerdo con las necesidades metabólicas del organismo, el TAP la libera para convertirla en calor. Entonces, el pardo posee la función primordial de cooperar en la regulación de la temperatura corporal, jugando un rol de relevancia en mamíferos hibernantes y en aquellos pequeños y/o recién nacidos. Más aún, el desarrollo del TA es siempre característico y dependiente de la especie analizada. Los adipocitos del TAP poseen gran cantidad de mitocondrias y expresan en la membrana mitocondrial interna UCP1 (UnCoupling Protein 1), lo que le permite la transformación de energía en forma de calor.
El TAP desarrolla durante la gestación y la etapa perinatal, y en recién nacidos y jóvenes de especies que no tiritan para producir calor. Preferentemente se localiza adjunto a túnicas vasculares y órganos vitales. En la mayoría de las especies de mamíferos su desarrollo se detiene y en algunos se mantiene latente hasta que la expresión génica se ve activada, por ejemplo, por descenso en la temperatura exterior. Es conocido que en el ser humano, el TAP puede convertirse en TAB, pero no la recíproca.
A diferencia del TAP (polilocular), el TAB no se caracteriza por el contenido intra-adipocitario de multivacuolas lipídicas, sino que a la observación microscópica apropiada resulta unilocuolar. Todos los adipocitos expresan receptores adrenérgicos, los del TAB: b3 y a2, y los del TAP b3, dada la inervación simpática de los mismos.
Esta actividad adrenérgica induce lipólisis. Los adipocitos de ambos TA poseen, además de la función de reserva energética, la correspondiente secretora.
2 – Función Endocrina del Tejido Adiposo: Adipoquinas
Cuantitativamente, el factor más relevante secretado por los adipocitos son los ácidos grasos. Aunque también secretan colesterol, retinol, esteroides y prostaglandinas. Algunas de ellas si bien no son sintetizadas in situ, ocurre la transformación dentro de estas células. Sin embargo, luego del clonaje del gen ob y la identificación del producto proteico secretado, leptina (l6 kD), encargado de transmitir al hipotálamo el estado del balance energético periférico, no se registraron dudas sobre la actividad adipocitaria sobre el control del apetito.
Estudios posteriores arrojaron información sobre una importante cantidad de sustancias expresadas en el adipocito y secretadas por esa célula. Si bien el TAP expresa ob, el TAB es el mayor productor de leptina. En la figura se esquematizan algunos de los productos expresados y secretados por el adipocito. Estas moléculas, hoy denominadas adipoquinas, afectan un amplio espectro de funciones biológicas y metabólicas, tales como el metabolismo hidrocarbonado y el lipídico, la acción y secreción de insulina, el balance energético, los mecanismos de defensa inmunológicos, y la biología reproductiva, por nombrar algunos.
3 – Regulación de Apetito y Saciedad
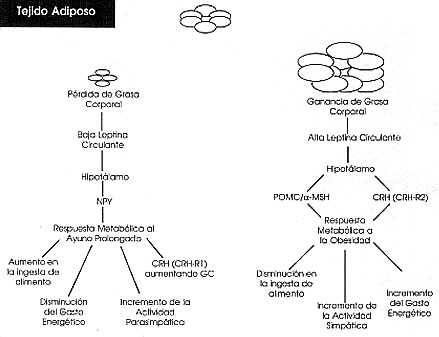
En el hipotálamo existen centros reguladores de la ingesta de alimento. En el núcleo arcuato (AN) se sintetiza el NPY -factor orexígeno fisiológico- que coexiste en ese núcleo con neuronas productoras de POMC (sustancia central anorexígena por excelencia). La POMC inhibe al NPY y por consiguiente su interrelación funcional es fundamental. Sin embargo al AN llegan otras señales ( Orexígenas: beta-endorfina, galanina, ácido gamma-amino-butírico; Anorexígenas: a-MSH, neurotensina) originándose así un juego entre estímuladores e inhibidores del apetito cuyo balance final resultará de la suma algebraica de ambos.
El núcleo ventromediano (VMN) es considerado el centro de la saciedad, y el área hipotalámica lateral (HLA) como el centro del apetito; el núcleo perifornical hipotalámico (PFN) posee neuronas productoras de neuropéptidos llamados orexinas (sustancias orexígenas); el núcleo paraventricular (PVN), produce CRH, sustancia que a través de receptores específicos en el AN (CRH-R2, a diferencia de los adenohipofisarios, CRH-Rl), inhiben al NPY (luego CRH es anorexígeno). Los núcleos supraquiasmáticos (SQN) están involucrados en el ritmo circadiano de incorporación de alimento. La señal anorexígena más importante de origen periférico es la leptina, polipéptido producido por los adipocitos, que informa al hipotálamo de la reserva energética periférica disponible.
La carencia genética de leptina da origen a uno de los fenotipos de obesidad, ya que al no existir una señal fisiológica de saciedad se produce hiperfagia. El mismo proceso puede condicionarse por la falta de expresión de receptores para leptina que genera un estado de leptino-resistencia, generándose el fenotipo de obesidad más frecuente en el humano.
La zona hipotalámica correspondiente al núcleo dorsomediano (DMN) actuaría como receptora de la señal de leptina en terminales neuronales NPY. Por el contrario, una disminución sustancial de masa corporal (especialmente grasa) disminuye la producción de leptina aumentando el apetito y permitiendo la recuperación de la masa perdida.
Recientemente se describió un péptido de 28 aminoácidos denominado Ghrelin (Gh: hormona de crecimiento, y relin: liberación de..), que estimula la secreción de GH. Su principal sitio de origen es el estómago, aunque pequeñas cantidades derivan del intestino, riñón, hipófisis, placenta e hipotálamo. Como se mencionó, durante el ayuno prolongado disminuye la leptina circulante (señal anorexígena disminuida) y aumenta la de Ghrelin, mientras que a nivel del hipotálamo, se incrementa la actividad NPY-érgica (orexígena) y se inhibe la POMC-érgica (anorexígena). Estos hallazgos indicarían que el NPY sería la señal de “hambre”, en contraposición con la leptina (señal periférica de saciedad). La proteína relacionada agouti (AGRP), co-producida en las neuronas NPY del AN, es un antagonista endógeno central de a-MSH (anorexigénica); se ha establecido que al aumentar la expresión de NPY aumenta la AGRP (reforzando la estimulación del apetito a nivel central). Existen otros neuropéptidos estimulantes del apetito como el sistema orexina/hipocretina (Hcrt) y hormona concentrante de melanina (MCH), cuyas neuronas se hallan, fundamentalmente, en el LHA.
4 – Obesidad / Anorexia y Actividad HHA
Leptina es una hormona adipocitaria que, entre otros efectos, también modula la función reproductiva. Leptina, en concentraciones circulantes normales, es necesaria para la apropiada liberación pulsátil de LHRH hipotalámico que, en turno, estimulará las células gonadotropas adenohipofisarias, encargadas de liberar en forma pulsátil las gonadotrofinas (LH y FSH), hormonas encargadas de regular la función gonadal.
Es sabido que elevadas concentraciones circulantes de leptina en forma crónica (como ocurre en obesidad) resultan en el deterioro de la función gonadal por acción directa a nivel glandular (disminuyendo la producción de testosterona testicular y estradiol/progesterona ováricas).
Contrariamente, los estados de anorexia se caracterizan por estrés crónico, en los que aumenta la expresión hipotalámica de CRH, y éste, a través de su acción sobre receptores CRH-R2 presentes en el AN, disminuyen la expresión de NPY, y se desarrolla una inhibición del apetito, asociada con disturbios en la producción de cortisol (niveles elevados y/o pérdida del ritmo circadiano).
Adicionalmente, una elevada producción de CRH hipotalámico resulta en un efecto inhibitorio de LHRH, así induciendo una disminución de la secreción de gonadotrofinas (LH y FSH) hipofisarias, y, finalmente, esto se refleja con hipofunción gonadal.
Se han dilucidado mecanismos de interrelación entre estrés y patologías relacionadas con cambios de la conducta alimentaria. Como antes se ha mencionado, el neuropéptido Y (NPY) y el CRH hipotalámicos, regulan los centros hipotalámicos controladores del apetito (hipotálamo lateral) y de la saciedad (hipotálamo ventromedial). NPY está presente en neuronas del AN, y, “per se” o en combinación con otras sustancias orexigénicas, tales como ghrelina, galanina, melanocortina (MCH) y GABA, regularía el centro del apetito.
Contrariamente, CRH junto a a-MSH poseen efectos anorexigénicos. Aunque, la primordial función de CRH se debe a que una sub-población neuronal del núcleo PVN proyecta sus terminaciones celulares en la zona externa de la eminencia media y resulta neurosecretado en la sangre porta-hipofisaria para activar la función hipofiso (CRH-Rl)-
corticoadrenal.
La otra característica funcional de CRH, es decir su efecto anoréctico, se debe a una acción neuromoduladora directa sobre la zona neuronal encargada de regular el centro apetito/saciedad, y probablemente actuando junto a a-MSH. Cabe resaltar entonces que mientras NPY estimula, contrariamente CRH inhibe el apetito.
Hay estudios que avalan una inter-regulación paracrina entre NPY y CRH hipotalámicos; un aumento de NPY se ha asociado con un posterior aumento de CRH, mecanismos que podrían estar indicando que uno de los eslabones involucrados en la fisiología apetito/saciedad estaría representado por un aumento transitorio de NPY y que, a su turno y posiblemente debido a señales periféricas, ese fino nivel regulatorio paracrino de NPY induzca un aumento, transitorio y hasta que sea suficiente, de CRH hipotalámico que, al menos, parcialmente (ya que podría haber otros factores tales como una disminución del tono NPY-érgico), inhiba el apetito.
Además, recientemente se ha clarificado una importantísima señal de origen periférico que es capaz de regular la actividad central (NPY y CRH) moduladora del centro apetito/saciedad: leptina; esta señal se encuentra localizada en el cromosoma 6 y la expresión de su mRNA, y como consecuencia del péptido mismo, aumentan en el adipocito de individuos con diferentes fenotipos de obesidad, para luego aumentar sus niveles circulantes, dada la función endocrina adipocitaria. Los niveles incrementados de leptina circulante directa/indirectamente llevarían el mensaje a nivel del SNC para inhibir la actividad NPY-érgica del AN, y posiblemente aumentar la apropiada CRH-érgica del PVN, resultando en forma orquestada una regulación del apetito.
Contrariamente, como ocurre en el ayuno, los niveles circulantes de leptina se encuentran disminuídos, mensaje que registrado en el SNC estimularía e inhibiría las actividades NPY- y CRH-érgicas, respectivamente. Los niveles circulantes de leptina se ven relacionados al contenido de grasa corporal y datos literarios indican una relación con la actividad del eje HHA; aunque es conocido un efecto regulatorio de los glucocorticoides sobre la síntesis y secreción de leptina. Mutaciones del gen de ob se traducen en síntomas tales como elevados niveles de glucocorticoides, los que resultan ser revertidos luego del tratamiento crónico con leptina.
Individuos normales en ayunas poseen elevados niveles periféricos de ACTH y, fundamentalmente, de glucocorticoides que pueden ser revertidos por administración de leptina. Recientemente, este efecto inhibitorio de la leptina sobre la actividad del eje HHA ha sido atribuido a un efecto inhibitorio adipocitario sobre la actividad CRH-érgica.
Los efectos inhibitorios de la leptina sobre la producción de glucocorticoide corticoadrenal resultan también ser directos; este efecto se ejerce fundamentalmente sobre la actividad enzimática STAR, encargada de modular el ingreso de colesterol citoplasmático a la mitocondria, aunque también parecería afectar la actividad del sistema P450 intra-mitocondria. La secreción de leptina es pulsátil y describe un ritmo circadiano inverso al de la secreción de glucocorticoide.
La leptina circula en forma libre y unida a proteínas transportadoras, posee una vida media aproximada de 90 minutos, su actividad se ejerce por su unión a receptores específicos pertenecientes a la familia de los de citoquinas, su principal rol es regular el balance energético a través de señalizar el contenido de grasa corporal, y es removida de la circulación fundamentalmente por el riñón. La leptina regula positivamente la secreción pulsátil de gonadotrofinas y por lo tanto, en la mujer, la de estradiol; de esta manera se explicaría por qué los estados de anorexia y bulimia femeninos (hipoleptinemia crónica) cursan con anovulación y por consiguiente con oligo/amenorrea.
Se ha establecido que la leptina es liberada durante la fase aguda de un shock séptico, estado anoréctico caracterizado por incrementos en la liberación de citoquinas (e.j. TNFa), sin embargo, en infecciones recurrentes /crónicas, la leptina se encuentra disminuida, reflejando probablemente un mecanismo adaptativo para la fase de recuperación del individuo.
Bibliografía sugerida
1. T.J. GUZIK, D. MANGALAT, R. KORBUT. Adipocytokines novel link between inflammation and vascular function? Journal of Physiology and Pharmacology 2006, 57, 505-528
2. J.M. ZIGMAN, J.K. ELMQUIST Minireview: From Anorexia to Obesity-The Yin and Yang of Body Weight Control. Endocrinology 2003, 144; 3749-3756
3. R. PASQUALI, V. VICENNATI, M. CACCIARI, U. PAGOTTO The Hypothalamic-Pituitary-Adrenal Axis Activity in Obesity and the Metabolic Syndrome. Ann. N.Y. Acad. Sci. 2006, 1083: 111-128
4. P. DANDONA, A. AUADA, A. CHAUDHURI, P. MOHANTY,R. GARG. Metabolic Syndrome: A Comprehensive Perspective Based on Interactions Between Obesity, Diabetes and Inflammation. Circulation.2005, 111: 1448-1454
|
|



