Valor del sedimento urinario
en el diagnóstico de Malacoplaquia
Autores: Fernando Guerra, Miguel Torresin, Carlos Audisio, Adriana Rocher, Anabela Angeleri, Mabel Lardo y Luis Palaoro. Realizado en: Laboratorio AUTOR, Laboratorios de Citología y de Hematología (Dpto de Bioq Clínica, FFyB,UBA) del Hospital de Clínicas José de San Martín |
Introducción
Malacoplaquia es una reacción inflamatoria crónica poco frecuente que generalmente afecta el tracto urinario en asociación con infección por E. coli. La extensión extravesical suele ser rara pero más agresiva. El término Malacoplaquia fue acuñado por von Hansemann en 1903 y se deriva de las palabras griegas malakos (blando) y plakos (placa) (1). Un año antes de la publicación del trabajo de von Hansemann, Michaelis y Gutmann publicaron resultados similares, y por lo tanto estos dos autores están asociados con esta enfermedad, casi olvidando a von Hansemann (2).
La Malacoplaquia, en la vejiga urinaria, se detecta comúnmente como placas ovales, de color amarillento con umbilicación central. Histológicamente, esta placas muestran numerosos macrófagos, células llamada von Hansemann, con muchos cuerpos dentro y fuera de estas células, llamadas cuerpos de Michaelis-Gutmann. Los cuerpos tienen un aspecto de estructuras concéntricas o de "ojo de búho" debido al desarrollo de un núcleo central de hidroxiapatita. Casi el 95% de los cuerpos son de material orgánico, siendo el resto hierro, calcio, fósforo, cloro y azufre (3). Estas estructuras, patognomónicos de Malacoplaquia, son positivos para la tinción de von Kossa (calcio), de Perls (hierro) y periodic -ácido-Schiff (PAS) ( 4). Hasta el momento, la tinción de Giemsa no se probó en estos cuerpos.
El tracto urinario es el sitio más común para Malacoplaquia y 80-90% de los pacientes tienen una infección persistente a coliformes (5).
Sin embargo, Malacoplaquia puede estar asociada con la infección por microorganismos distintos de E. coli incluyendo otras bacterias, micobacterias, y hongos (6).También se informó de la enfermedad, en menor medida, en el retroperitoneo, el tracto gastrointestinal, pulmón, nódulos linfáticos, lengua, etc (7,8). Malacoplaquia también está asociada con estados de inmunodeficiencia y enfermedades malignas hematopoyéticas (9). La asociación de Malacoplaquia con inmunosupresión proviene del hallazgo de la enfermedden pacientes con antecedentes de tratamiento prolongado con agentes quimioterapéuticos o inmunosupresores.
Malacoplaquia es probablemente el resultado de un defecto adquirido en la función de los macrófagos que causa un deterioro de la actividad bactericida. Ahora se cree que la enfermedad puede estar relacionada con el montaje microtubular anormal. Los microtúbulos son responsables de la normal invaginación y la desgranulación de los lisosomas, que son importantes en la destrucción de bacterias en la fagocitosis. GMP cíclico estimula mientras AMP cíclico inhibe el ensamblaje de microtúbulos. Por otra parte, la función lisosomal también depende de la enzima β-glucuronidasa y el estado redox de la célula (10).La alteración en el estado redox, con la reducción en la relación de cGMP / cAMP podrían ser los factores desencadenantes en Malacoplaquia.
En apoyo de esta teoría, se ha informado de monocitos con inclusiones lisosomales intracitoplasmáticas, liberación anormal de la enzima b-glucuronidasa, bajos niveles intracelulares de GMP cíclico y la actividad bactericida deprimida en Malacoplaquia retroperitoneal (11).
Por lo tanto, los tratamientos con betanecol, droga agonista colinérgico, tienen como objetivo aumentar la concentración intracelular de GMPc.
Algunos agentes antimicrobianos, capaces de penetración intracelular, como trimetoprim-sulfametoxazol se utilizaron con cierto éxito. Además, hubo casos de Malacoplaquia tratados con éxito por la ciprofloxacina (12).
Casos reportados
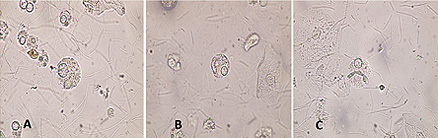
• Figura 1: Células de von Hansemann en sedimentos de orina en fresco. A: Abundantes células con cuerpos de Michaelis-Gutmann (MG) B: Célula de von Hansemann con un gran cuerpo de MG elongado C: Célula de von Hansemann con un cuerpo de MG con forma de gusano (Aumento: 400x)
La primer observación de células compatibles con las definidas como células de von Hansemann fue realizada en un sedimento de orina en fresco, de una paciente con repetidas infecciones a coliformes, con historia de resistencia a antibióticos. La muestra presentaba abundantes macrófagos con inclusiones redondeadas, ovales o elongadas, a veces con forma de gusano. (Figura 1) Estas inclusiones recordaban a los cuerpos de Michaelis - Gutmann, según se muestran en las microfotografías del libro de Koss (13 ).
Por lo que pudimos analizar en la literatura, éste es el primer informe de la detección de cuerpos de Michaelis-Gutmann en muestras de orina fresca. Los mismos hallazgos se repitieron en tres muestras más. Para confirmar la sospecha de esta patología, se realizaron coloraciones de Papanicolaou, PAS y Giemsa. (Figura 2).
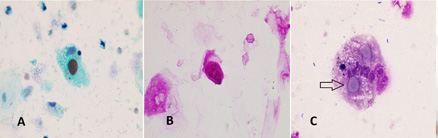
• Figura 2: Células de von Hansemann teñidas con Papanicolaou, PAS y Giemsa. A: Célula de von Hansemann con gran cuerpo de MG redondeado (Papanicolaou) B: Coloración PAS positiva en célula con cuerpos de MG C: Técnica de Giemsa en macrófago con cuerpos de MG, uno de los cuales exhibe borde marcado y un "core" central (Flecha) (Aumento: 400x)
Los cuerpos se tiñen principalmente de rojo con Papanicolaou, de rojo intenso con PAS, y con Giemsa apenas toman una tenue coloración celeste. Sin embargo, en esta última coloración es posible observar, en algunas células, el cuerpo denso central de las inclusiones, que recuerda a un blanco de tiro, tal como fueron descriptas por microscopía electrónica (14). Este hallazgo se reporta por primera vez en la literatura de esta patología.
La biopsia vesical realiza el diagnóstico histopatológico de Malacoplaquia y confirma los datos obtenidos por citología.
La participación de la vejiga se asocia con síntomas urinarios irritativos y hematuria; un diagnóstico correcto es importante debido a la posibilidad de propagación a los uréteres con estenosis bilateral y obstrucción, que puede concluir con insuficiencia renal (15).
Al correlacionarse las células observadas en sedimentos de orina en fresco con los resultados obtenidos en las diferentes coloraciones y en las biopsias vesicales, puede concluirse que el diagnóstico de Malacoplaquia puede inferirse a partir de exámenes rutinarios de orina, especialmente en pacientes con historia de resistencia a antibióticos en infecciones a coliformes. La importancia del reconocimiento de las células de von Hansemann en las muestras de orina permitirá el uso de drogas más específicas, de mayor utilidad en las cistitis a repetición asociadas a Malacoplaquia.
Referencias
1- von Hansemann D. Uber Malakoplakie der Harnblase. Virch Arch Path Anat 1903; 173: 302–8
2- Dasgupta P, Womack C, Turner AG and Blackford HN. Malacoplakia: von Hansemann's disease. Review.BJU International 1999, 84, 464–9
3- Sencer O, Sencer H, Uluoglu O, Torunoglu M, Tatlicioglu E. Malakoplakia of the skin. Ultrastructure and quantitative x-ray microanalysis of Michaelis–Gutmann bodies. Arch Pathol Lab Med 1979; 103: 446–50
4- Kohl SK, Hans CP. Cutaneous malakoplakia. Arch Pathol Lab Med 2008; 132: 113–117
5- Stanton JM, Maxted W. Malacoplakia: a study of the literature and current concepts of pathogenesis, diagnosis and treatment. J Urol 1981; 125: 139–46
6- Velásquez López JG, Vélez Hoyos A, Uribe Arcila JF. Malacoplaquia en urología: aportación de seis casos y revisión de la literatura. Actas Urol Esp 2006; 30: 610-8
7- Shimizu S, Takimoto Y, Nimura T, Kaya H, Yamamoto T, Kawazoe K et al. A case of prostatic malacoplakia. J Urol 1981; 126: 277–9
8- Alvarez Gomez GJ, Martin Botero ML, Henao Calle CA, Duque Serna FL. Malacoplakia: Case report in tongue and review of the literatura. Med Oral Patol Oral Cir Bucal 2008;13:E352-4
9- Matsuda I, Zozumi M, Tsuchida YA, Kimura N, Liu NN, Fujimori Y et al. Primary extranodal marginal zone lymphoma of mucosa-associated lymphoid tissue type with malakoplakia in the urinary bladder: a case report.Int J Clin Exp Pathol. 2014;7:5280-4
10-Zurier RB, Weissman G, Ho¢stein S, Kammerman S, Tai HH. Mechanisms of lysosomal enzyme release from human leukocytes. II. Effects of cAMP and cGMP, autonomic agonists, and agents which affect microtubule function. J Clin Invest 1974; 53: 297–309
11-Abdou NI, NaPombejara C, Sagawa A, Ragland C, Stechschulte DJ, Nilsson U et al. Malakoplakia:evidence for monocyte lysosomal abnormality correctable by cholinergic agonist in vitro and in vivo. N Engl J Med 1977; 297: 1413–9
12-van Furth R, van't Wout JW, Wertheimer PA, Zwartendijk J: Ciprofloxacin for treatment of malakoplakia. Lancet 1992; 339:148-9
13-Koss LG. Diagnostic cytology and its histopathologic bases. J.B.Lippincott Company. Philadelphia, Third Ed, 1979, p 735
14-Kern WF, Silva GF. Atlas of Renal Pathology. W. B. Saunders Company, Philadelphia, 1999, p. 147
15 - Steele B, Vade A, Lim-Dunham J. Sonographic appearance of bladder malacoplakia. Pediatr Radiol. 2003; 33: 253-5.
Realizado en: Laboratorio AUTOR, Laboratorios de Citología y de Hematología (Dpto de Bioq Clínica, FFyB,UBA) del Hospital de Clínicas José de San Martín Correspondencia: Luis Palaoro – Avda Forest 1318 4ºB (1427) CABA, Bs As, Argentina-mail: luispalaoro@yahoo.com.ar |
|
|