|
|||
|
| ARG |
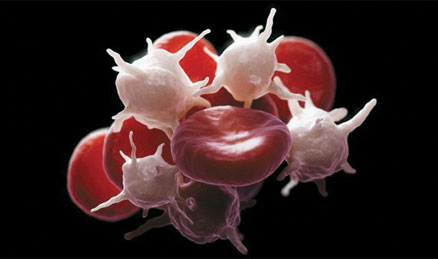
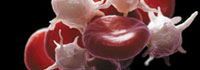
Dilucidan el rol de los neutrófilos en los eventos cardiovasculares Por Ana M. Pertierra Este hallazgo, que revela un proceso biológico del que participan mediadores químicos, células sanguíneas y proteínas y que explicaría cómo neutrófilos y plaquetas cooperan para iniciar un accidente vascular, acaba de publicarse en la prestigiosa revista Science y es el resultado de un trabajo llevado a cabo en ratones por un grupo de investigadores del Centro Nacional de Investigaciones Cardiovasculares de Madrid, liderados por el doctor Andrés Hidalgo en colaboración con grupos de la Universidad Complutense de Madrid, y de especialistas de Alemania, Estados Unidos y Japón.
• ¿Cómo han llegado a determinar la interacción que se produce entre neutrófilos y plaquetas dentro de los vasos sanguíneos? ¿Y en qué consiste esa colaboración celular para desencadenar un evento cardiovascular? Tanto neutrófilos como plaquetas son componentes muy abundantes de la sangre (de ratón o humana) y por tanto son fáciles de identificar. Como nos interesaba entender su colaboración en un contexto biológico usamos microscopía intravital de fluorescencia, una técnica que permite visualizar lo que ocurre dentro de vasos vivos. El uso de fluorescencia fue particularmente importante porque nos permitió marcar según nos interesaba unas células u otras, e incluso moléculas de interés para seguir sus dinámicas in vivo. Lo que descubrimos es que en vasos sanguíneos inflamados los neutrófilos aparecían primero y emitían unas protrusiones hacia el interior del vaso. Esta protrusión o "uropodo" es la que permitía la captura de plaquetas circulantes, de modo que cuando se adherían plaquetas activadas éstas mandan señales activadoras al neutrófilo, que adquiere entonces plenas capacidades inflamatorias que contribuyen al daño cardiovascular. • ¿Cuál fue el principal objetivo del trabajo que llevaron a cabo y que han publicado en Science? ¿Esperaban estas conclusiones o se vieron sorprendidos por sus hallazgos? Nuestra intención era entender mejor como estos dos tipos celulares, que han sido ampliamente relacionados con el daño inflamatorio, colaboraban en este proceso. Que lo hiciesen no fue tan sorprendente, ya lo sospechábamos, pero sí la manera en la que este proceso ocurre. Lo que nos sorprendió fue por un lado la elegancia del proceso biológico, y por otro lado la identificación de varias de las moléculas implicadas y la capacidad de usarlas como dianas terapéuticas. •¿Cómo está integrado el equipo de investigación y qué tecnologías aplicaron para su desarrollo? Mi laboratorio en ese momento estaba compuesto por 3 estudiantes y 3 investigadores postdoctorales, además de dos personas para soporte técnico. El trabajo de todos ellos y el uso de técnicas avanzadas de imagen microscópicas y no microscópicas, como la tomografía computarizada fue fundamental para el éxito del trabajo. •¿Cuánto tiempo les demoró arribar a las conclusiones y con qué modelo animal hicieron los ensayos? Como cualquier trabajo de investigación con cierta ambición, este fue un proyecto largo que empezó durante mi período posdoctoral en Nueva York (en el laboratorio del Dr. Paul Frenette del Mount Sinai School of Medicine). En total estimo que fue un proceso de unos 5 años. El modelo central de nuestro estudio fue el ratón, no solo porque tiene un sistema cardiovascular con cierta semejanza con el humano, sino sobre todo porque aporta unas herramientas genéticas esenciales para este tipo de estudios. • ¿Qué mecanismo de interacción celular lograron esclarecer y qué regiones celulares y proteínas están involucradas? Demostramos que la interacción se establece en una región específica que se forma rápidamente en neutrófilos adheridos a vasos inflamados. En concreto identificamos que la proteína PSGL-1 (P-selectin glicoprotein ligand-1) se acumula en esta región o urópodo del neutrófilo y reconoce con alta afinidad a otra proteína presente en plaquetas activadas. •¿Avizoran las repercusiones que pueden tener estos hallazgos en el mediano plazo? Por supuesto, aunque esto requerirá estudios adicionales en humanos. Según lo hallado en ratones, predecimos que este proceso de ser funcional en el hombre permitirá atajar el daño vascular que ocurre en muchos tipos de dolencias cardiovasculares, desde ictus cerebral, daño pulmonar o choque séptico. • ¿Se podrían extrapolar los resultados que obtuvieron para ser aplicados en humanos? • ¿Qué influencia pueden tener dichos resultados en las alternativas terapéuticas contra los accidentes cardiovasculares? Pueden ser importantes porque hasta la fecha hay pocas alternativas para atajar la severidad de estos accidentes. Lo que proponemos es que bloquear este proceso de activación de neutrófilos los hace mucho menos dañinos contra los vasos afectados incluso cuando el accidente se ha iniciado. En el trabajo identificamos maneras de conseguir este bloqueo de manera eficiente. • ¿Qué proyectos de investigación tienen previstos a futuro en el CNIC? Muchos, quizás demasiados, pero es difícil reprimir las ganas de aprender más de cómo funciona nuestro sistema cardiovascular y las células que fluyen por la sangre. Una área de especial interés es entender cómo el tiempo (es decir, la hora del día) condiciona la función de leucocitos y plaquetas. Esto es biológicamente fascinante, y de interés terapéutico, porque desde hace mucho tiempo sabemos que los humanos (y mamíferos en general) somos más susceptibles a sufrir accidentes cardiovasculares al final de nuestro reposo diario, es decir en las primeras horas del día. Entender por qué ocurre esto y cómo podemos usarlo en nuestro beneficio es uno de nuestros nuevos retos.
|
|
| Subir | ^ |
La bioquímica en el diagnóstico de cáncer de mama y ovario |
 |
Dilucidan el rol de los neutrófilos en los eventos cardiovasculares |