La bioquímica en el diagnóstico
de cáncer de mama y ovario
Mediante una metodología de secuenciación de ADN de última generación se detectan mutaciones específicas y hereditarias para los genes BRCA 1 y BRCA 2 que aumentan el riesgo de cánceres de mama y ovario en mujeres. Para su correcta interpretación, bioquímicos especializados elaboran un informe completo de los hallazgos encontrados mediante estas técnicas de análisis de ADN de alta eficiencia y velocidad.

• Dra. Ángela Solano, bioquímica especialista en Genética y Biología molecular, Profesional Principal del CONICET
Por Ana M. Pertierra
El riesgo de una mujer de padecer cáncer de mama o de ovarios aumenta considerablemente si hereda una mutación dañina en el gen BRCA 1 o en el BRCA 2. Los hombres con estas mutaciones también presentan un riesgo mayor de cáncer de mama así como de otros tipos de cánceres.
Las pruebas genéticas que se hacen en muestras de sangre pueden buscar las mutaciones del BRCA1 y BRCA2 en personas que tienen antecedentes familiares que sugieren la presencia posible de una mutación dañina en uno de esos genes.
Los genes BRCA 1 y el BRCA2 son genes humanos que producen proteínas involucradas en mecanismos de reparación del ADN dañado por lo que tienen una función de mantener la estabilidad del material genético de las células. Cuando uno de estos genes tiene una mutación, o alteración, que determina que no se produzca la proteína o que no funcione correctamente, el daño de ADN no puede ser reparado y como resultado las células tienen más probabilidad de presentar alteraciones genéticas adicionales que pueden conducir al cáncer.
FABAINFORMA dialogó con la Dra. Ángela Solano, bioquímica, especialista en Genética y Biología molecular, Profesional Principal del CONICET, Coordinadora de la Sección Estudios genéticos en cáncer en el Departamento de Bioquímica Humana de la Facultad de Medicina de la UBA y Coordinadora de Genotipificación y cáncer hereditario del CEMIC, quien acaba de ser designada delegada para asistir al BRCA Challenge meeting en la sede de la UNESCO en París los próximos días 12 y 13 de junio. Solano es la primera bioquímica argentina que integra los consorcios internacionales dedicados al análisis genético y/o de laboratorio y que conforman una Alianza mundial para la salud genómica.
"Se acaban de cumplir los 20 años del descubrimiento de los genes BRCA1 y BRCA 2. Y si bien todavía el análisis genético tiene un nivel de complejidad alto, ahora ofrece una oportunidad impensable en otro momento", comenta la especialista.
En cuanto a la evolución metodológica de los últimos años, Solano explica que "la secuenciación completa de los genes BRCA1 y BRCA2 es un estudio muy complejo porque se analizan 20.000 nucléotidos, sin embargo, la reciente incorporación de la nueva tecnología NGS (New Generation Sequence) ha permitido lo que se denomina la secuencia masiva paralela que permite analizar en un solo chip hasta 20 BRCA juntos (muestras de 20 pacientes) en el aparato de un laboratorio de tamaño pequeño".
No obstante, la experta recalca la importancia de la interpretación de los resultados y el informe de los hallazgos metodológicos. "Es indispensable que un especialista evalúe los resultados del análisis", dijo.
El aparato brinda un cúmulo de información que el profesional experimentado puede interpretar para darle real valor al informe. "El aparato emite una planilla de Excel con todo los cambios que detecta al enfrentar la muestra con un DNA que se considera el más frecuente para esos genes: los polimorfismos individuales del gen BCRA que son normales, los sinónimos (cambia una base nucleotídica pero no el aminoácido que codifica), las mutaciones patogénicas, y aún las variantes de significación incierta (VUS)". Ahora bien –agrega la especialista– es el bioquímico experimentado quién deslinda esta información, el que sabe leer las variantes. "Todas las variantes que se presentan dudosas se corroboran con el método de Sanger, que es el gold estándar, y con las reglas de nomenclatura se determina el nombre y luego se va a las bases internacionales (BIC) que indican si esa mutación es o no patogénica".
Indicaciones para el estudio
Según las indicaciones del NCCN (National Comprehensive Cancer Network) que redacta y actualiza las guías para la prevención, detección y reducción del riesgo de los distintos tipos de cáncer, las personas a la que se les indicaría este estudio genético son a aquellas mujeres con antecedentes familiares de cáncer de mama y ovario y a los hombres con cáncer de mama. Y todos los casos deberán hacerse bajo el amparo de un asesoramiento genético oncológico que incluya el consentimiento informado.
"Si una persona es sana y no tiene antecedentes familiares no corresponde hacer un estudio de BRCA", enfatiza la especialista.
El varón es portador silencioso de las mutaciónes de BRCA 1 y BRCA 2 y eso quiere decir que si bien algunos tienen cáncer de mama y es condición suficiente para indicar el estudio, la mayoría de los portadores no tiene manifestación oncológica pero si esa mutación la hereda una hija tiene el mismo riesgo que si la hubiera heredado de la madre.
El estudio indicado de las mutaciones de BRCA 1 y BRCA 2 no cubre el 100% de la patología, es decir, con estas dos mutaciones se cubre el 50% de los casos pero eso no significa que el 50% restante no tenga algún tipo de mutación. "Todavía no se sabe si la mutación está en los intrones o en otros genes. No se puede afirmar que si no se detectan las mutaciones BRCA 1 y BRCA 2, no haya otras mutaciones teniendo en cuenta los antecedentes, hay una caja negra donde cae ese 50%", aclara la bioquímica.
Mientras que cuando se detecta la mutación es determinante. "La presencia de la mutación aumenta la probabilidad de padecer un cáncer", recalca la especialista.
La mutación de los genes BRCA 1 y BRCA 2 tiene un carácter autosómico dominante. Estar enfermo o ser portador de la mutación no significa que va a trasmitir la mutación a toda la descendencia. Sin embargo, hay poblaciones raciales o étnicas que tienen una mayor frecuencia de mutaciones dañinas. Tal es el caso de las personas de descendencia judía askenazí.
"La población general tiene un espectro de más de 3.000 mutaciones distintas mientras que la rama judía entre sefardíes y askenazi tienen pocas mutaciones, siete, pero la frecuencia es muy alta de 1:40", señala Solano.
Incertidumbre del resultado
"En condiciones óptimas de trabajo el estudio tiene un 100% de especificidad. Si la mutación existe en las zonas (del genoma) analizadas no hay manera de no detectarla", subrayó la especialista.
Cuando se detecta la mutación deletérea de los genes BRCA 1 y BRCA 2 es determinante ya sea que la persona sea sana o enferma, hombre o mujer. La presencia de la mutación aumenta la probabilidad de padecer un cáncer. Cuando a una persona enferma no se le encuentra la mutación, significa que la mutación estará en otra región del genoma.
Aunque, una de las grandes preocupaciones de los especialistas en el mundo es encontrar variantes de significado incierto (VUS, por sus siglas del inglés). "Las VUS se detectan pero todavía no se sabe si están asociadas a la enfermedad", detalla Solano. Y –añade– en el informe hay que deslindar perfectamente cuáles son las variantes benignas, las inciertas y las patogénicas.
La especialista aclara que mientras el portador de la mutación tiene altísimas chances –entre el 60 y 80%– de desarrollar cáncer de mama y/u ovario, el cáncer hereditario constituye tan solo un 5 a 10% del total de estos cánceres. "El cáncer de mama y ovario hereditario es raro, y más del 95% de los casos es de carácter esporádico", sostuvo. Y– agregó– la mujer que no tiene estas mutaciones no tiene alto riesgo pero sigue teniendo un riesgo de 1:8 (12%) de desarrollar cáncer de mama sobre todo en la menopausia por lo que se recomiendan los controles periódicos a través de mamografías.
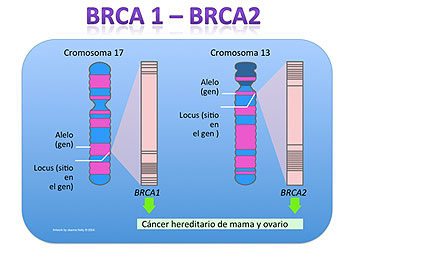
El análisis de los genes BRCA 1 y 2 Identifica las mutaciones genéticas germinales (hereditarias) las cuales están asociadas a un aumento del riesgo de padecer cáncer de mama y/u ovario y otros tumores relacionados. La secuenciación completa de los todos los exones y los bordes intrón/exón permite detectar la mutación, de las cuales ya hay descriptas mas de 3000 variantes distintas. En nuestra población no hay un panel definido conocido y la secuenciación completa es el análisis indicado para asegurar un estudio informativo. Se informa la mutación familiar (fundamental para analizar familiares portadores y no portadores) y las variantes genéticas detectadas.
|
|