NUEVO SUBPROGRAMA
PEEC-Inmunohematología
Continuando con la expansión de la cobertura del PEEC y poder brindar a todos los laboratorios una herramienta más en la evaluación externa, anunciamos el comienzo de un nuevo subprograma en el area de la inmunohematología. Este subprograma tendrá una frecuencia semestral y inicialmente se trabajará en la identificación de grupo sanguíneo y factor Rh.
Inmunohematología para control externo de Grupo ABO y Factor Rh.
La coordinación de este subprograma estará a cargo de la Dra. Amelia Racca de la Universidad Nacional de Rosario y el Dr. Jorge Rey perteneciente al servicio de Hemoterapia del Hospital Clínicas de la Universidad de Buenos Aires. Los materiales de control se elaborarán -en principio- en la cátedra de Hematología de la Facultad de Ciencias Exactas de la Universidad Nacional de La Plata a cargo de la Prof. Dra. Nilda Fink.
Se ha programado el envío de la primera encuesta para el segundo semestre del año 2008.
TOXOPLASMOSIS:
Diagnóstico serológico
La Toxoplasmosis es una enfermedad cosmopolita producida por un protozoario: Toxoplasma gondii, frecuentemente es asintomática en las personas inmunocompetentes. La toxoplasmosis puede adquirirse a través de la ingesta de alimentos contaminados o carne cruda o insuficientemente cocida.
La toxoplasmosis congénita acontece cuando la mujer embarazada susceptible( no posee anticuerpos) adquiere la infección y ocurre transmisión placentaria. El desafío para el laboratorio consiste en determinar el momento de la adquisición de la infección.
El diagnóstico se basa principalmente en tests serológicos que incluyen la titulación de la inmunoglobulina G específica y la detección de la IgM específica(1).
La serología para toxoplasmosis es difícil de interpretar por diversas razones: a) la mayoría de los ensayos serológicos no se basan en resultados de pacientes que hayan documentado estar infectados con el parásito ya que la detección del microorganismo o sus antígenos ocurre raramente; b) por la falta de estandarización en la expresión de los resultados; y c) por la diversidad en sensibilidad y especificidad de la gran variedad de
métodos disponibles (2).
La aparición de un aumento significativo de título de IgG en muestras pareadas obtenidas con intervalo de tiempo entre 14-21 días es indicativo de infección aguda. Pero la gran mayoría de las veces es muy difícil de detectar, a menos que la primera muestra sea marginalmente positiva. Otro dato a tener en cuenta es que el tiempo en alcanzar el máximo nivel de IgG varía mucha de una paciente a otra, se ha documentado que este pico se alcanza entre 4 a 36 semanas (3).
• El algoritmo propuesto por la reunión de consenso de TOXOPLASMOSIS CONGENITA de la Asociación Argentina de Zoonosis (AAZ) es el siguiente:
El desarrollo de anticuerpos específicos para toxoplasma gondii varía mucho en la mujer embarazada con primoinfección para Toxoplasmosis. La variación es en cuanto a la concentración de anticuerpos producidos y el momento en que se produce el máximo. En general la mujer que responde fuertemente en un test lo hace en otros ensayos y viceversa(3).
La determinación de IgG anti-toxoplasma debe realizarse por métodos que aseguren una alta sensibilidad en la infección aguda. Es apropiada la determinación de IgG por Enzimoinmunoanálisis, Inmunofluorescencia Indirecta, Aglutinación Directa, Sabin Feldman. No debe utilizarse la Hemoaglutinación indirecta para el diagnóstico de Toxoplasmosis aguda ya que se positiviza hasta 2 meses después de iniciada la infección (4)
La IgM está presente en la infección aguda se eleva a niveles altos entre la 2 a 5 semanas y permanece varios meses, hasta 2 años lo que dificulta el diagnóstico.
La IgM debe realizarse mediante una técnica de Inmunocaptura ( para eliminar falsos positivos y negativos). La misma metodología debe utilizarse para determinar IgA. Son adecuados los métodos de ISAGA ( Inmunosorbent Agglutination Assay) y ELISA IgM /IgA Doble sándwich.
Todas las muestras que resulten positivas para IgG e IgM deben complementarse con otras reacciones IgA específica, test de avidez para IgG anti-toxoplasma.
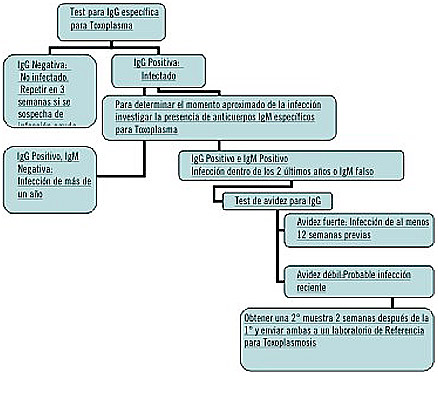
• A continuación se presenta el algoritmo de las pruebas de tamizaje y diagnóstico para Toxoplasmosis según el CDC. (http://www.dpd.cdc.gov/dpdx)
No utilizar una técnica como única herramienta diagnóstica, sabiendo que las diferentes técnicas no se reemplazan entre sí sino que se complementan.
La mujer embarazada con anticuerpos IgG negativos debe controlarse durante el embarazo para poder detectar una posible conversión serológica. Se ha sugerido que el primer control se realice en las primeras 12 semanas de gestación, y controles trimestrales, el último entre la semana 36 y el parto. Las pacientes susceptibles deben ser informadas de las medidas higiénico-dietéticas para evitar la infección(5).
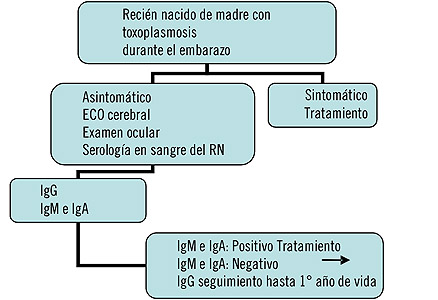
En el recién nacido la IgG materna no puede diferenciarse de la IgG propia del niño por esto en el bebé debe investigarse la presencia de IgM e IgA específicas que no atraviesan la placenta. Los anticuerpos de clase IgM e IgA desaparecen meses después del nacimiento pero en el caso de la Toxoplasmosis congénita los de clase IgA permanecen más tiempo que los de clase IgM. El perfil serológico del bebé en el momento de nacer depende del período de gestación en el cual se infectó in útero. Cuando la infección ocurre en el tercer trimestre de gestación el niño al nacer o en las semanas siguientes posee IgA e IgM simultáneamente. En contraste cuando la infección ocurre en el 1° trimestre, el niño al nacer está al final de la fase aguda de infección fetal, caracterizada por ausencia de anticuerpos IgM ( los que probablemente aparecieron durante la vida fetal) pero pueden detectarse anticuerpos IgA específicos(6).
El recién nacido asintomático se sigue evaluando hasta el año de vida en el que se investiga la IgG específica que debe ser negativa como criterio de certeza de ausencia de infección cuando se ha demostrado infección en la madre.
Si la mujer embarazada es susceptible recordar las medidas de prevención:
< Evitar el contacto con materiales que pudieran estar contaminados con materia fecal de gatos, emplear guantes si se debe manipular dichos materiales.
< Desinfectar los canastos de los gatos con agua hirviendo durante 5 minutos.
< Utilizar guantes para tareas de jardinería
< Evitar el contacto de moscas y cucarachas con alimentos como carnes, frutas y vegetales.
< Cocinar la carne (66°C) antes de consumirla.
< Lavar frutas y vegetales antes de consumirlos.
< Evitar el contacto con membranas mucosas cuando se manipula carne cruda o frutas y verduras no lavadas.
< Lavado de manos y de las superficies de la cocina, luego de contacto con carne cruda, frutas y vegetales.
La diversidad de métodos disponibles para la serología de Toxoplasmosis exige por parte de los laboratorios la normatización de los procedimientos, de la expresión de los resultados, la implementación de control de calidad interno y la participación en programas de evaluación externa de calidad.
Los métodos directos involucran inoculación de ratones de líquido amniótico o sangre de cordón del neonato, los resultados demoran entre 3 a 6 semanas con una sensibilidad del 64% ( Desmonts et al, Hohlfel et al.). La detección de ADN de Toxoplasma gondii por la técnica de polimerización en cadena en líquido amniótico requiere estandarización porque puede dar falsos positivos y/o negativos, la sensibilidad es de alrededor de 97.4% (7), con especificidad del 96%. Se sugiere recurrir a esta técnica en pacientes con infecciones ya confirmadas y luego de transcurrido un mínimo de 6 semanas de la infección aguda. No se recomienda su uso en casos de dudas diagnósticas(5).
Bibliografía
1. Hofgärtner W, Swanzy S, Bacina RM, et al. Detection of Immunoglobulin G (IgG) and IgM Antibodies to Toxoplasma gondii: Evaluation of Four Commercial Immunoassay Systems. J Clin Microbiol 1997; 35(12): 3313-5
2. Wilson M, Remington J, Clavet C et al. Evaluation of Six Commercial Kits for Detection of Human Immunoglobulin M Antibodies to Toxoplasma gondii. . J Clin Microbiol 1997; 35(12): 3112-5.
3. Jenum P, Stray- Pedersen B. Development of Specific Immunoglobulins G, M, and A Following Primary Toxoplasma gondii Infection in Pregnant Women. J Clin Microbiol 1998; 36(10): 2907-13
4. D'Agostino LE. Diagnóstico serológico de toxoplasmosis. Actualización. Acta Bioquím Clín Latinoam 1994; 28(3): 399-403
5. CONSENSO TOXOPLASMOSIS CONGENITA. Reunión de los días 30 de setiembre y 1 de octubre de 2005, en Buenos Aires. Asociación Argentina de Zoonosis (AAZ).
6. Decoster A, Slizewicz B, Simon J, et al. Platelia - Toxo IgA, a New Kit for Early Diagnosis of Congenital Toxoplasmosis by Detection of Anti-P30 Immunoglobulin A Antibodies. J Clin Microbiol 1991; 29(10): 2291-5
7. Hohfeld P, Daffos F, Costa JM, et al. Prenatal diagnosis of congenital toxoplasmosis with a polymerase-chain-reaction test on amniotic fluid. N Engl J Med 1994; 331(11): 695-9.
|