Estructuras de las toxinas de hongos superiores (Parte I)
El Comité de Redacción de Acta Bioquímica Clínica Latinoamericana ha seleccionado este artículo publicado en la Revista Industria & Química, Nº 352 de Mayo 2006, para su difusión a través de FABA Informa.
Alicia B. Pomilio, Miguel E. Battista y Arturo A. Vitale
PROPLAME (UBA y CONICET), Departamento de Química Orgánica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Pabellón 2, Ciudad Universitaria, C1428EHA Buenos Aires, E-mail: abpomilio@sinectis.com.ar
En nuestro país se han registrado una serie de intoxicaciones y casos fatales por ingestión de basidiocarpos que crecen en micorrizas de robles y otros árboles provenientes de Europa. Por lo tanto, nos pareció interesante analizar los compuestos orgánicos que están involucrados. Son estables al calor permaneciendo activos después de la cocción o del tratamiento del material alimenticio.
Benjamin (1995) estimó que hay por lo menos 400 especies de hongos superiores venenosos. Diferentes hongos tienen varios tipos de toxinas con diferentes modos de actividad. Hay 8 grupos básicos de toxinas fúngicas de hongos superiores (Tabla 1).
Tres grupos causan destrucción celular: 1 ) ciclopéptidos, 2) monometilhidrazina (giromitrina) y 3) orellanina; dos grupos afectan al sistema nervioso autónomo: 4) coprina y 5) muscarina; dos grupos afectan al sistema nervioso central: 6) panterina y 7) psilocibina y psilocina; y un gran grupo causa 8) irritación gastrointestinal (Editorial, 1980; Perez-Moreno y Ferrera-Cerrato, 1995; Lin y Wang, 2004).
a) Envenenamiento debido a los Ciclopéptidos
Este es el principal grupo de toxinas fúngicas, que corresponde aproximadamente al 90% de las fatalidades fúngicas registradas a nivel internacional. El grado de mortandad en los casos no tratados se encuentra entre el 20 y 30% .
Se identificaron anatoxinas (octapéptidos bicíclicos) y falotoxinas (heptapéptidos bicíclicos) (Wieland, 1986; Jensen, 2000). Estas toxinas son termoestables y no son removidas por cocción ni por secado.
La amanitina (Wieland y Faulstich, 1991) es un inhibidor de la ARN-polimerasa II, y así actúa en todas las células eucarióticas en las que ocurre la síntesis de proteinas, provocando destrucción celular. El hígado es el primer órgano en ser afectado (Kroncke et al., 1986), le siguen los riñones, y el sistema nervioso central. Las amatoxinas son captadas por las células que recubren los intestinos, donde la síntesis de proteínas se inhibe inmediatamente. Las toxinas son liberadas al torrente sanguíneo y transportadas al hígado. En el hígado se interrumpe inmediatamente la síntesis de proteínas. La amanitina es excretada en la orina, y la mayor parte es evacuada del cuerpo dentro de horas después de la ingestión. Sin embargo, si se afecta suficiente tejido hepático, el ataque hepático asegurará la muerte.
La dosis promedio que probablemente cause la muerte a un humano es de 6-7 mg y se encuentra fácilmente en el sombrero de un A. phalloides maduro. Sin embargo, como otras toxinas fúngicas, difiere la concentración que es fatal según el individuo, y en diferentes ejemplares, pues el ambiente influye en cuánta toxina puede ser producida en un basidiocarpo.
Las falotoxinas inhiben la actina F en el citoesqueleto celular. Actúan inmediatamente, y probablemente no se muevan más allá del revestimiento de los intestinos. Sin embargo, no actúan por vía oral, sólo lo hacen las amatoxinas.
Los valores de dosis letal de las amatoxinas (DL50) se indican en la Tabla 2 y sus estructuras en la Fig. 1.
Los valores de dosis letal de las falotoxinas (DL50) se indican en la Tabla 3 y sus estructuras en la Fig. 2.
Los individuos que hayan ingerido hongos tóxicos pueden no darse cuenta de este hecho por un tiempo, dado que los síntomas pueden no aparecer hasta 6 a 12 h, aún a las 48 h, después de la ingestión. Los primeros síntomas incluyen dolor abdominal agudo, náuseas, vómitos y diarrea acuosa o defecación sanguinolenta. Generalmente hay mucha sed. Durante el 3er. o 4to. día, aparecen ictericia, insuficiencia renal, convulsiones, y coma. Aparecen síntomas de meningitis con pupilas dilatadas, rigidez de cuello, y contracción nerviosa de los músculos faciales que preceden a las convulsiones. Una dosis letal es de 5-10 mg, por lo tanto, un hongo de sombrero podría matar a un adulto sano (Faulstich y Wieland 1996).
En realidad, los pacientes pasan por cuatro fases: (1) período latente asintomático, (2) fase gastrointestinal con diarrea masiva, vómitos, y deshidratación con consecuencias metabólicas como acidosis metabólica e hipoglicemia, (3) disminución de los síntomas con un período de aparente bienestar, y (4) una fase hepática (normalmente) comienza a las 36 a 48 h después de la ingestión) con un aumento de la enzimas hepáticas y daño hepático agudo.
Dosis múltiples de carbón activado garantizan un intento de interrumpir el reciclado entero-hepático que puede ocurrir con estas toxinas. Se puede considerar un aumento de diuresis y la posibilidad de usar antídotos específicos (Litovitz et al, 1999).
Los pacientes que podrían haber estado expuestos a estas toxinas fúngicas requerirán un monitoreo permanente respecto al daño hepático y al posible daño renal, y podrían requerir un transplante de hígado en los casos más severos (Langer et al, 1997).
Varias especies de Amanita (como: A bisporigera, A. ocreata, A. phalloides, A. virosa, A. verna), Galerina (como G. autumnalis), y unas pocas especies de Conocybe (Hallen et al, 2003), y Lepiota (como: L. josserandii y L. subincarnata) (Paydas et al, 1990; Parra et al, 1992) se encontró que contienen niveles altos de estos ciclopéptidos. Otras especies de Amanita, Cortinarius, y Lepiota son sospechosas de contener estas toxinas. Amanita phalloides ha causado más muertes que ningún otro hongo, probablemente debido a que su tamaño, forma y color recuerdan a algunos hongos comestibles.
En casi todo el mundo hay un grupo de Amanita similar a A. verna, uno de los 12 hongos llamados ángeles de la muerte (death angels) porque son de color blanco lechoso y mortales.
Las toxinas aisladas fueron identificadas por espectros UV y de masa (EM) y RMN.
Se determinaron las movilidades de amanitinas, faloidinas y virotoxinas por electroforesis en gel de poliacrilamida, provenientes de extractos de A. verna y A. phalloides (Bidnichenko, 1999). También se usaron electroforesis analítica y electroforesis capilar automática de alta resolución como control de la presencia de amatoxinas en extractos de Amanita y para monitorear la separación de ciclopéptidos. La electroforesis preparativa resultó muy eficaz para este tipo de compuestos (Battista,1999).
Se pudo relacionar la conformación de los ciclopéptidos de A. phalloides con su toxicidad (Battista et al, 2000). Se realizaron estudios de las estructuras electrónicas y las conformaciones de los ciclopéptidos: O-metil-a-amanitina, faloidina y antamanida, y se obtuvieron sus parámetros moleculares en base a métodos semiempíricos y ab initio (Battista et al., 2000).
Se obtuvieron las estructuras electrónicas, y se realizó el estudio conformacional de a-amanitina y sus derivados sintéticos: 0-metil-a-amanitina, S-desoxo-a-amanitina, a-amanitin-(S)-sulfóxido y a-amanitin-sulfona en base a métodos AM1 y ab initio (Pomilio et al, 2001 ). Se calcularon los cambios estereoquímicos, la energía total, mapas de potenciales electrostáticos, orbitales moleculares y momentos dipolares. En base a los resultados obtenidos se pudo explicar la capacidad de unión y la toxicidad mostrando la implicancia de los factores tanto estereoquímicos como electrónicos (Pomilio et al, 2001).
b) Envenenamiento por Giromitrina-monometilhidrazina (MMH)
MMH es una toxina hemolítica muy tóxica para el sistema nervioso central. Es también un irritante gastrointestinal y produce daños hepáticos. El envenenamiento debido a MMH tiene una historia larga y enigmática. En una reunión, 5 micofagistas (los que recolectan y comen hongos), por ejemplo, habrían todos consumido comidas preparadas con el mismo hongo. Dos se enfermaron violentamente, tres los disfrutaron sin problema. El chef, sin embargo, resultó el más violentamente enfermo, aunque no los había consumido. No fue hasta que comenzaran los viajes especiales que se pudo elucidar la causa del envenenamiento por especies de Gyromitra (Gyromitra brunnea, parecida a la morilla) y Helvella (Helvella lacunosa).
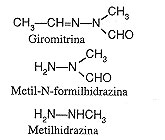
< En los extractos de Gyromitra esculenta, así como G. gigas, G. Infula, se encuentran giromitrina, N-metil-N-formilhidrazina y metilhidrazina (Fig. 3)
La toxina fúngica girometrina produce por hidrólisis el compuesto tóxico monometilhidrazina (MMH). La toxina tiene un punto de ebullición de 87,5 ºC, y como puede estar siendo destilada durante el proceso de cocción, produce una atmósfera tóxica para el cocinero.
Una vez más, el relativamente largo período de aparición de los síntomas (6 a 12 h) indica que puede tratarse de un severo envenenamiento. La intoxicación se caracteriza por algunos efectos iniciales: fatiga, mareos, vértigo, dolor de cabeza severo, una sensación de hinchazón, dolor abdominal, y posiblemente emesis. En los casos más serios pueden ocurrir convulsiones, coma, hemólisis y hepatitis aguda.
El antídoto para los síntomas amenazantes de vida, tales como convulsiones y coma, es piridoxina (vitamina B6). De lo contrario, el tratamiento es sintomático y de soporte.
No todos los individuos que consumen este hongo desarrollan síntomas, ya que cada persona tiene su propia tolerancia individualizada, debajo de la cual no hay síntomas visibles.
El riesgo de intoxicación depende de la forma de preparación. Al cocinarlos en una cacerola tapada se puede producir una ligera intoxicación con metilhidrazina que puede ser superada mediante el tratamiento con vitamina B6. El peligro de intoxicación con Gyromitra esculenta es fundamentalmente para ancianos, niños y pacientes con problemas de disfunción hepática.
Las metilhidrazinas son alquilantes y cancerígenas. La mortandad es del orden del 10%.
Se encontró que con el "combustible" de los cohetes espaciales que contaban con, entre otras cosas, gases de hidrazina, los tecnólogos de los cohetes experimentaban toda clase de síntomas raros, pero críticos. Los médicos pudieron determinar que el tipo de envenenamiento era idéntico al que sufrían las personas que habían comido especies de Helvella o Gyromitra. Los micólogos reexaminaron el principio tóxico de estos hongos y encontraron que en realidad liberaban MMH. En la actualidad sabemos que el nivel umbral de toxicidad de MMH difiere en cada individuo. Así, dos comensales comieron justo la cantidad para alcanzar el umbral de toxicidad mientras que en los otros tres no se alcanzó el dicho umbral. Ahora sabemos porqué el chef fue el más enfermo, ya que MMH fue liberada como gas durante la cocción de los hongos. Los síntomas no aparecieron hasta 6-12 h después de la exposición a la MMH, demasiado tarde para contrarrestar la intoxicación.
Sufrieron náuseas, vómitos, y diarrea con dolor abdominal. En casos severos ocurrió ictericia, pulso rápido, fiebre alta, mareos, desvanecimiento, pérdida de coordinación y raramente coma y muerte.
La desafortunada situación ocurre con estos hongos al confundir los amateurs las especies de Gyromitra con uno de los grupos de hongos comestibles preferidos, Morchella, las morillas. Los micólogos entrenados, sin embargo, no los confundirían.
Además de Gyromitra y Helvella, se sospecha que especies de Peziza, Sarcoscypha, Disciotis, y Verpa contienen MMH.
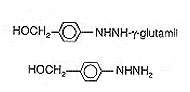
Agaricus bisporis es un hongo comestible, que contiene 0,3% de agaritina (glutamil-4-hidroximetilfenilhidrazina) que también es un derivado de hidrazina. Toth y Erikson (1977) describieron los efectos tóxicos, convulsivos y letales. Asimismo, propusieron que podía ser antagonizado mediante la administración preventiva y terapéutica de clorhidrato de piridoxina. Agaricus bisporis posee también una enzima del tipo de glutamil-transferasa, tal que se cuenta con la liberación de 4-hidroximetilfenilhidrazina (Fig.4)
C) Envenenamiento por orellanina o cortinarina
Los casos de envenenamiento con orellanina sólo se han confirmado en Europa. La toxina es principalmente nefrotóxica con un largo letargo (3 a 11 días y hasta 3 semanas) entre la exposición y la aparición de síntomas renales. Los primeros síntomas son: náuseas, vómitos y anorexia que son seguidos en unos pocos días por oliguria y sed quemante. Estos síntomas están frecuentemente acompañados con agotamiento, letargo, y falta de apetito. Los pacientes generalmente presentan: mialgia, en particular dolor lumbar, dolor de cabeza, escalofríos, rigores, culminando en daño renal.
Varios casos han resultado en ataque renal y hepático. Ocasionalmente pueden aparecer síntomas gastrointestinales suaves durante el período de latencia. La toxina es probablemente un óxido de bipiridilo (orellanina) (Fig. 5).
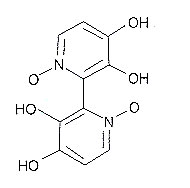
El grado de mortandad es de aproximadamente 15 %. El tratamiento es principalmente sintomático, pero si el paciente es admitido en el hospital dentro de las 24 h después de la comida (muy inusual), se puede realizar descontaminación gastrointestinal y hemodiálisis en un intento por eliminar la toxina.
Las toxinas de orellanina fueron encontradas solamente en ciertas especies de Cortinarius, como: c. gentilis, c. orellanus, c. orellanoides, c. semisanguineus, c. specciossimus (pequeño hongo mortal en las montañas del Jura, Marais des Saignolis, Suiza) y otros, que pueden causar destrucción celular al ser consumidos.
El resumen sería:
Existen al menos 400 especies de hongos superiores venenosos con distintos tipos de toxinas. Las toxinas fúngicas se clasifican según causen destrucción celular, afecten el sistema nervioso central, al sistema nervioso autónomo o provoquen irritaciones gastrointestinales. Los compuestos orgánicos involucrados son estables al calor y permanecen activos después de la cocción o del tratamiento del material alimenticio. Los casos fatales por intoxicación con estas toxinas ameritan su estudio detallado.
|
|



