Investigación:
Hepatitis C: Conceptos de resistencia a nuevas drogas antivirales - AAD
El Comité de Redacción de Acta Bioquímica Clínica Latinoamericana ha seleccionado este artículo publicado en Informe ALAC Ciencia y Ética, Año XX, Número 2 – 2015, pp. 23, 24, 26 y 28 para su difusión a través de FABAInforma
|
|
Por Javier Alejandro Sfalcin.
Licenciado en Biotecnología. Líder de Biología Molecular del Laboratorio Cibic / jsfalcin@cibic.com.ar
Introducción
El tratamiento de la Hepatitis C ha sido foco de investigación y desarrollo de los principales laboratorios farmacéuticos. Como resultado de este arduo trabajo se están aprobando múltiples drogas antivirales de acción directa (AAD) para utilizar en tratamientos contra la Hepatitis C crónica. Estas drogas brindan excelentes tasas de respuesta virológica sostenida (RVS) y disminución de los efectos adversos más comunes. Las tasas de RVS han ido en aumento desde el año 1991 -cuando se inició la era del interferón (IFN), donde se curaba una pequeña porción de los pacientes tratados- hasta la actualidad donde se curan más del 90%, independientemente del esquema utilizado y del estado de salud del paciente (1).
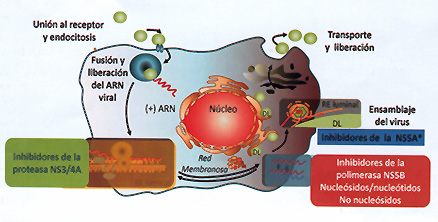
• Figura 2. Sitio de acción de las diferentes drogas antivirales en el ciclo de replicación viral del virus de la Hepatitis C. (Adaptado de Manns MP, et al. Nat Ret Drug Disco: 2007; 6: 991-1000)
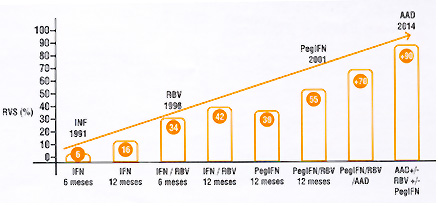
• Figura 1. Evolución del tratamiento contra la Hepatitis C crónica
Si bien la mayoría de los individuos se benefician con los nuevos tratamientos, se deberá tener precaución a la hora de elegir la combinación de antivirales a utilizar. En un futuro no muy lejano habrá disponibilidad de múltiples esquemas con tasas de respuesta muy elevadas, sin embargo la elección de los mismos deberá ajustarse a las características de cada individuo y esto será crucial a la hora de evitar optar por esquemas subóptimos. Más allá de la eficacia en el éxito de la terapia, la aparición de cepas resistentes y la propagación de las mismas en la población podría ser una problemática a corto plazo, que deberla ser prevenida. Por otro lado, el elevado costo de los nuevos tratamientos implica un esfuerzo en conjunto para optimizar la utilización de los recursos económicos, de manera tal que la elección del tratamiento se deberá realizar priorizando la costo/efectividad del mismo, para transitar con firmeza el camino hacia la erradicación de la Hepatitis C (1).
Nuevas drogas antivirales
Los antivirales de acción directa son moléculas dirigidas a proteínas virales involucradas en el ciclo de replicación del VHC. La interacción entre las moléculas antivirales y las proteínas virales provoca el bloqueo de diferentes etapas del ciclo de viral, erradicando la infección por el virus. El principal beneficio de las nuevas terapias radica en un aumento de las tasas de RVS a valores por encima del 90%, ya sea utilizando esquemas combinados con o sin Interferón.
La posibilidad de eliminar el Interferón conlleva a una gran reducción en los efectos adversos. Otro beneficio de las nuevas drogas es su elevada potencia, la cual permitiría disminuir considerablemente los tiempos de duración del tratamiento (2).
Los antivirales están agrupados en diferentes familias según la proteína viral a la cual están dirigidos. Por un lado los inhibidores de la proteasa NS3/4A (IP), encargada del procesamiento de la poliproteína viral. Una segunda familia de moléculas, dirigida a la proteína NS5A, un cofactor de la polimerasa viral que también actúa en el ensamble del virus dentro de la célula y un tercer grupo de antivirales, los inhibidores de la polimerasa viral NS5B, una ANA polimerasa esencial en la replicación del genoma viral (Figura 2) (2).
¿Cómo escapa el VHC a los AAD?
El virus de la Hepatitis C tiene una elevada tasa de replicación de 1012 viriones por día y utiliza una polimerasa sin corrector de prueba, que acumula múltiples cambios en la secuencia del genoma viral a través de los distintos ciclos de replicación. Estos cambios provocan que el VHC tenga una alta variabilidad genética, motivo por lo cual se lo ha clasificado en 7 tipos y múltiples subtipos. Cuando se profundiza el estudio de los genomas virales, la presencia de diferentes sitios hipervariables (polimorfismos), a lo largo de la secuencia del virus, explica que cuando una persona se infecta con el VHC, no lo hace con una población de virus idénticos, sino con una población de virus, con pequeñas modificaciones entre sí, llamadas cuasi-especies virales (Figura 3).
Los cambios observados en la secuencia del genoma viral a través de las diferentes cuasiespecies, subtipos y genotipos virales, son de suma importancia, ya que contribuyen a reducir la barrera genética de los antivirales, definida por la cantidad de mutaciones necesarias para que el antiviral pierda su actividad. La variabilidad genética del virus y la capacidad de acumular cambios, sumadas a la presión de selección de las drogas antivirales provoca la aparición de variantes asociadas a resistencia durante el tratamiento en todos los pacientes, incluso hasta dobles mutantes con capacidad replicativa suficiente para ocasionar el escape virológico a los AAD (3).
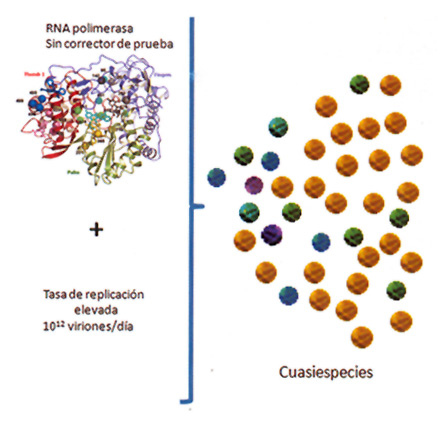
• Figura 3. Generación de cuasiespecies virales.
Para contrarrestar este problema, las nuevas drogas antivirales han sido diseñadas de manera tal que son capaces de reducir la carga viral a valores indetectables en un corto período de tiempo, debido a su elevada potencia antiviral. La potencia previene la aparición de mutaciones de resistencia durante el tratamiento y permite reducir los tiempos de duración del mismo. Más allá de esto, debido a la baja barrera genética de los AAD, los nuevos esquemas de tratamiento cuentan con reglas de discontinuación (Stopping Rules) que indican que al detectar carga viral a un determinado tiempo de iniciada la terapia, la misma deba ser discontinuada. Esta conducta se ha adoptado con el fin de evitar que cepas con mutaciones de resistencia, acumulen otras mutaciones que mejoren su capacidad replicativa y, además de provocar la falla al tratamiento, perduren en el paciente infectado con posibilidades de ser propagadas al resto de la población.
Por todo esto, los esquemas de tratamiento deben llevarse a cabo con la máxima adherencia, asegurando la potencia necesaria para prevenir el escape viral y lograr el objetivo de la misma, eliminar la infección (4).
Más allá de la alta efectividad de los nuevos tratamientos, existe un grupo de pacientes en los cuales la terapia antiviral aún no logra eliminar la infección y en este grupo de pacientes es donde hay que poner la lupa, para identificar los mecanismos que desencadenan la falla al tratamiento y de esta manera accionar contra los mismos para evitarlos.
AAD y variantes asociadas a resistencia (RAVs)
Uno de los mecanismos de escape más importante es la aparición de variantes asociadas a resistencia (RAVs). Estas variantes, son cambios en la secuencia del genoma viral que reducen la interacción entre el antiviral y su target, provocando la pérdida de susceptibilidad a la acción del antiviral. Se han descripto múltiples RAVs, las mismas pueden ser basales, intra tratamiento o post tratamiento. Estas variantes generalmente reducen la capacidad replicativa o fitness viral, sin embargo como comentamos anteriormente, la acumulación de múltiples mutaciones provoca una recuperación de la capacidad replicativa que lleva a la falla del tratamiento (5).
Se ha publicado la existencia de RAVs a todos los inhibidores de proteasa (IP), Como la mayoría de los AAD, esta familia de antivirales tiene una baja barrera genética, por lo cual la aparición de algunas mutaciones es suficiente para evitar la acción del antiviral.
Estas mutaciones disminuyen la capacidad replicativa del virus y una vez retirado el antiviral en la falla, las variantes resistentes desaparecen en un corto período de tiempo a expensas de las cepas salvajes (Wild Type, WT) (Figura 3) (6), Mas allá que en un corto período de tiempo post tratamiento prevalecen las cepas WT, las principales guías de recomendaciones indican no re-tratar pacientes con IP, si han sido tratados previamente con antivirales de esta familia debido a la existencia de resistencia cruzada (5).
Además de las variantes adquiridas por presión de selección de las drogas existen polimorfismos basales pretratamiento asociados a resistencia a IP Más específicamente, la variante QBOK, presente en un alto porcentaje de los pacientes infectados con genotipo 1 a, reduce las tasas de RVS en pacientes tratados con SIMEPREVIR, motivo por el cual, resulta mandatario el testeo de esta variante en los pacientes con genotipo 1a que serán tratados con este IP (1,5,7). Los inhibidores de NS5A son antivirales muy potentes y en combinación con diferentes drogas se obtienen tasas de replicación extremadamente altas. Al igual que los inhibidores de la proteasa, estos antivirales tienen una baja barrera genética. Sin embargo, la potencia de estas drogas, sumada a la interacción del antiviral con regiones de gran importancia para la función de la enzima (sitio catalítico) hace que la aparición de mutaciones asociadas a esta familia sea prácticamente nula (3).
Por último, el grupo de antivirales inhibidores de la polimerasa viral NS5A se subdividen en dos clases, análogos nucleósidos o no nucleósidos. Son los únicos AAD con alta barrera genética. Más allá de esto, se han reportado múltiples RAVs en pacientes tratados con esta familia de antivirales, Además, a través de los diferentes genotipos se han identificado polimorfismos basales asociados a resistencia que condicionarían la respuesta al mismo, sobretodo en pacientes infectados con genotipo 3.
Por otro lado, las variantes asociadas a resistencia a inhibidores de NS5B, a diferencia de las asociadas a los otros AAD, no disminuyen considerablemente el fitness viral con respecto a la cepa WT: motivo por el cual, permanecen en el individuo por largos períodos de tiempo, una vez discontinuado el tratamiento (Figura 4) (3). La ocurrencia de este fenómeno condiciona el retratamiento con AAD de la misma familia antiviral ya que al igual que con los IP existe resistencia cruzada entre los diferentes antivirales de esta familia (5).
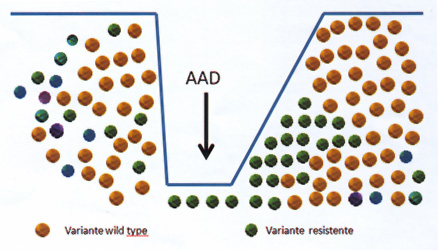
• Figura 4. Generación de variantes asociadas a resistencias. Escape y recuperación del fitness
Test de resistencia a AAD
Los datos acerca de la resistencia a AAD usados en el tratamiento de la Hepatitis C se están acumulando rápidamente. Se han publicado tablas de mutaciones de resistencia asociadas a cada AAD (3, 8). Además existen bases de datos y software de análisis, similares a los utilizados para estudiar la falla al tratamiento con antirretrovirales en la triple terapia contra el VIH (ww.w.Geno2pheno.com). Sin embargo, a diferencia del VIH, el tratamiento de la Hepatitis C es finito, y la dinámica con la cual evolucionan las poblaciones virales dentro del individuo son poco conocidas.
No se ha establecido aún la verdadera utilidad del test de resistencia a AAD. Si bien las guías de recomendaciones incluyen el testeo de la variante OBOK en los pacientes con genotipo 1a que serán tratados con SIMEPREVIR, no especifican claramente cuando es necesario el test genotípico de resistencia. Por ello la aplicación de esta tecnología en la era de los nuevos antivirales contra VHC se encuentra en un estado reservado, a la espera de nuevas investigaciones que pongan en el lugar indicado a esta poderosa herramienta con la que contamos en el laboratorio (1,5).
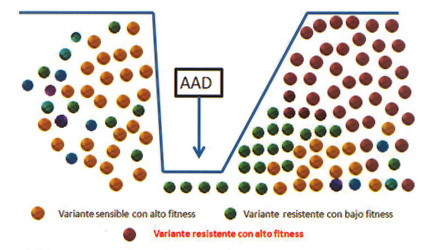
• Figura 5. Escape virológico a expensas de variantes resistentes con alto fitness
|
|





