El desarrollo de nuevas tecnologías en el laboratorio de semen
Fragmentación del DNA espermático
Bioq. Susana Curi, Bioq. Patricia Chenlo, Bioq. Norma Pugliese, Dra. Gabriela Mendeluk, Bioq. Julia Ariagno, Dra Ana Maria Blanco - Laboratorio de Fertilidad Masculina Facultad de Farmacia y Bioquímica. Hospital de Clínicas Gral. San Martín, UBA.
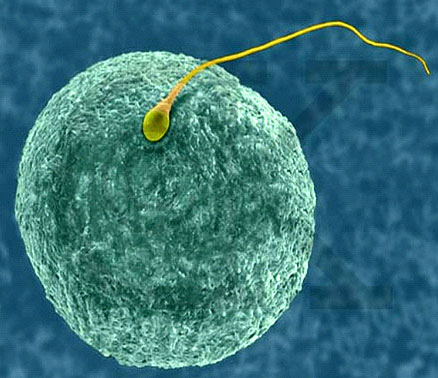
La gameta masculina es un portador especializado que tiene como funci ón fundamental transportar el material genético al ovocito.
Las pruebas tradicionales: movilidad, morfología y recuento espermático, examinan al transportador. Las pruebas de integridad del DNA evalúan el material transportado, el DNA del espermatozoide.
¿Qué es la fragmentación del DNA espermático?
En el interior del núcleo espermático el DNA se encuentra unido a un tipo de proteínas básicas llamadas protaminas, esta unión recibe el nombre de nucleoprotamina y se encuentra en estado muy condensado, lo que le otorga protección al material genético.
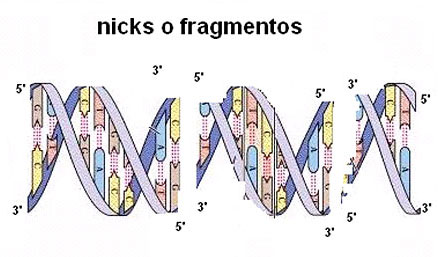
Por diversas causas el DNA empaquetado en la cromatina, puede sufrir fracturas, conocidas como nicks, tanto en la cadena simple como en la doble hélice, fenómeno que recibe el nombre de FRAGMENTACION del DNA.
¿Por qué puede ocurrir fragmentación del DNA?
Las tres causas principales que pueden provocar nicks o fragmentos son:
• El estrés oxidativo puede inducir oxidación de las bases nitrogenadas del
DNA lo que provoca en primera instancia la formación de bases oxidadas (8-OH-guanosina y 8- hidroxi 2’ deoxiguanina) y luego la fragmentación de la doble hélice. La oxidación del DNA puede ser reparado en cierta medida por el ovocito, pero la ruptura de la doble cadena del DNA es irreversible e incompatible con la fertilización normal y el desarrollo de un embarazo viable.
• En las espermátides, durante el proceso de reemplazo de las histonas nucleosomales por protaminas, puede provocarse daño del DNA por torsión debido a que se produce un superenrollamiento del material genético. Este proceso se alivia con la formación de nicks, que normalmente son reparados por acción de la topoisomerasa II antes que culmine la espermatogénesis y previo a la eyaculación. Si la actividad de esta enzima no es normal, los Nicks no pueden ser reparados y permanecen en los espermatozoides eyaculados, maduros y morfológicamente normales.
• La apoptosis, muerte celular programada, juega un rol fisiológico en la producción de las células germinales, regulando la sobreproducción, restringiendo la proliferación anormal y evitando que sobrepase la capacidad de la célula de Sértoli. La apoptosis ocurre en el testículo durante la espermatogénesis por acción de endonucleasas, predominantemente en la espermatogonia y en células en división, generando numerosas rupturas de las cadenas del DNA.
Los factores externos que influyen en la fragmentación del DNA espermático son: El daño inducido por radio o quimioterapia, el varicocele, la exposición a tóxicos ambientales o a temperaturas extremas, y las enfermedades inflamatorias agudas y crónicas.
¿Cuando es conveniente estudiar la fragmentación del DNA?
Siempre que se requiera conocer el estado de integridad del DNA será conveniente efectuar alguna de las técnicas desarrolladas a tal fin. Sin embargo la bibliografía sugiere que esta prueba presenta mayor valor predictivo cuando se aplica a pacientes con fallos repetidos en reproducción asistida, mala calidad embrionaria, pacientes con aborto a repetición o infertilidad idiopática.
¿Que procedimientos bioquímicos permiten estudiar la fragmentación del DNA?
Las pruebas para la detección de la fragmentación del DNA pueden ser clasificadas en dos tipos de acuerdo al tipo de daño que miden:
1) Daño real: TUNEL (Terminal deoxiUridil transferasa mediated Nick End Labeling), ISNT (In Situ Nick Translation) o Test del Cometa, en condiciones de pH neutro.
2) Daño potencial y susceptibilidad de desnaturalización: SCSA (Sperm Chromatin Structure Assay), SCD (Sperm Chromatin Dispersion), Cromomicina A3 o Cometa en condiciones pH desnaturalizante.
Debido a que el pH intracelular del ovocito es aproximadamente 7.0, la detección de daños de la cadena simple del DNA serán de poca o ninguna consecuencia para la formación de los pro núcleos debido a que a pH neutro, las cadenas de DNA no se disociarán por lo que las pruebas que detectan el daño real tendrán un valor predictivo superior que aquellos que revelan el daño potencial.
En conclusión, la presencia de cadenas simples de DNA rotas en el DNA paterno por encima de un límite crítico, puede, no necesariamente, provocar fallas en el embarazo después de una reproducción asistida. Sin embargo, la presencia de extensas rupturas de doble cadenas y altos niveles de 8-OH-guanosina y 8OH-2’-deoxiguanina, como los producidos después del daño inducido por el radical hidroxilo durante el transporte a través del túbulo seminífero y el epidídimo, podrían comprometer severamente el desarrollo del embrión. Sin embargo, si no hay un daño significativo del DNA, la probabilidad que un embarazo viable se garantice dependerá de:
1- La proporción de espermatozoides con daño en el DNA, la dimensión de DNA fragmentado por célula y el nivel de 8-OH-guanosina y 8OH-2’- deoxiguanina en el espermatozoide.
2- Las regiones de DNA que estén dañadas ( intrones y exones)
3- La habilidad del ovocito fertilizado para reparar el daño.
¿Cómo proceder en caso que la fragmentación del DNA supere el valor
límite?
El valor límite de DNA fragmentado en muestras eyaculadas propuesto por la bibliografía para el método de TUNEL, es de 15% para microscopía de fluorescencia y y 30% para citometría de flujo, sin embargo este puede variar de acuerdo a la sensibilidad y especificidad que requiera la toma de decisión terapéutica.
El tratamiento de primera elección es el uso de antioxidantes (Vitamina C y E) y posterior uso de técnicas de selección espermática. Pero frente a altos niveles de daño en el DNA espermático y/o asociación con oligoastenoteratozoospermia la bibliografía sugiere efectuar ICSI con espermatozoides testiculares.
El laboratorio de Fertilidad Masculina de la Facultad de Farmacia y Bioquímica de la UBA a través de Transferencia Tecnológica de la UBA ha desarrollado la Prueba de TUNEL por Citometría de Flujo, la Prueba de Naranja de Acridina y Cromomicina A3.
Para información comunicarse al 5950-8656 o curis@fibertel.com.ar.
Bibliografía sugerida
1- Alvarez J.. The predictive value of sperm chromatin structure assay. Human Reprod.2005; 20:2365-67
2- Evenson, Dp et col. Utility of sperm chromatin structure assay as a diagnosic and prognostic tool in the human fertility clinic. Hum Reprod, 1999. 14(4): 1039-49.
3- Evenson, Dp; Larson KL; Jost LK. Sperm Chromatin Structure Assay: its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques. J Androl, 2002. 23(1):25-43.
4- Greco E., Icobelli M., Rienzi L., Ubaldi F., Ferrero S., Tesarik J. Reduction of the incidente of sperm DNA fragmentation by oral antioxidant treatment. J androl, 2005. 26:3
5- Greco et al. Efficient treatment of infertility due to sperm DNA damage by ICSI with testicular spermatozoa. Human Reprod 2005. 20:1, 226-230.
6- Gorczyca W., Gong J., Darzynkiewicz Z. Detection of DNA strand breaks in individual apoptotic cells by the in situ terminal deoxynucleotidyl transferasa and nick translation assays. Cancer Res 1993;53: 1945-51.
7- Han-Ming Andchoon-Nam Ong “detection of oxidative DNA damage in human sperm and its association with sperm function and male infertility “Free Radical Biological and Medicine 2000. 28; 4, 529-536.
|