El
shock y sus causas
El Comité de Redacción de Acta Bioquímica Clínica
Latinoamericana ha seleccionado este artículo publicado en
la Revista Investigación y Ciencia -junio 2004-, para su
difusión a través de FABA Informa.
La investigación reciente abre nuevas vías
para el tratamiento de este descenso de la presión arterial
que a menudo resulta letal
Donald W. Landry y Juan A. Oliver
Ojos vidriosos y la mirada perdida. Cualquiera que sea su causa -un ataque cardíaco, un accidente de tráfico, una infección bacteriana grave-, el shock preludia a menudo la muerte del sujeto catatónico. Sólo en EE.UU., cada año medio millón de personas caen en ese estado de shock súbito. La mitad de ellos mueren. Para varios millones más, constituye la última etapa de una enfermedad terminal. La raíz del shock se encuentra en una bajada de la presión arterial, que da lugar a una insuficiencia circulatoria, es decir, a una reducción del volumen de sangre que llega a los tejidos. Esta alteración se torna fatal cuando la anoxia daña de forma irreversible el cerebro y otros órganos vitales. Pueden tomarse varias medidas para conjurarlo antes de que sea demasiado tarde; pero no es infrecuente que fallen, en particular si el shock se debe a una infección incontrolada.
Ante tales efectos devastadores y su prevalencia, los expertos se afanan por desarrollar tratamientos más eficaces. Pese a las esperanzas iniciales, varias de las moléculas candidatas a convertirse en fármacos han fracasado en los últimos años. Sin embargo, un hallazgo reciente, fortuito, nos ha llevado a una terapia prometedora. Si bien el medicamento en cuestión no evita el shock, sí permite aliviar a millares de víctimas de éste. Con suerte, nuestro planteamiento y el de otros podrían augurar una nueva etapa terapéutica.
Presión arterial
No podemos ahondar en la naturaleza del shock sin antes comprender la fisiología del sistema circulatorio. La vida primitiva en los antiguos mares de la Tierra se apoyaba en un principio físico sencillo para obtener oxígeno y nutrientes y liberarse del dióxido de carbono y materiales de desecho: la difusión. En este proceso, las moléculas viajan, de forma natural, desde zonas de concentración elevada hacia otras de concentración menor. Pero este fenómeno de transporte resultaba eficiente sólo cuando se trataba de recorrer distancias milimétricas. Los organismos de cierta talla necesitaban un mecanismo más potente. La naturaleza solucionó el problema con el desarrollo del sistema circulatorio: la sangre se encargaría de portar las biomoléculas hasta puntos alejados. Para la mayoría de los organismos, el corazón constituye la fuerza impulsora de este flujo, que, a su vez, distribuye gases y nutrientes esenciales por todo el cuerpo.
La sangre rica en oxígeno entra en contacto con los tejidos a través de una red de vasos que culminan en los capilares, vasos diminutos y muy permeables. Las arterias llevan la sangre desde el corazón a las arteriolas, de menor luz, que a su vez la conducen hasta los capilares. Para que la sangre circule, el corazón debe generar una fuerza que venza la resistencia que encuentra a su paso, conforme se van estrechando los vasos. La presión arterial mide la fuerza que la sangre ejerce contra los vasos sanguíneos cuando el corazón se contrae (presión sistólica o máxima) y se relaja (presión diastólica o mínima).
El corazón del hombre bombea alrededor de cinco litros de sangre a través de unos 15 kilómetros de vasos sanguíneos unas 1.000 veces al día. Una interrupción del flujo de sangre durante seis segundos escasos puede dejar inconsciente a un individuo. Basta un descenso moderado de la presión arterial para privar de oxígeno al cerebro y dejar a un paciente lívido, si no se desmaya. En cuestión de minutos, otros órganos empiezan a resentirse. Se entra entonces en estado de shock. Si éste persiste y los órganos quedan irreversiblemente dañados, llega la muerte.
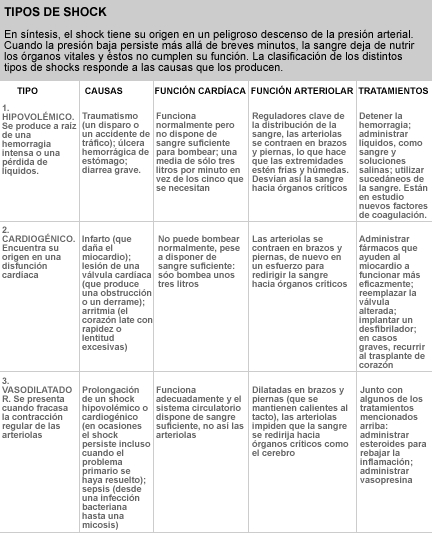
La clasificación de los distintos tipos de shock responde a las causas que los desencadenan. Son diversas. Uno de los más frecuentes, el shock hipovolémico se produce por una caída brusca del volumen sanguíneo. Ello ocurre, por ejemplo, cuando un traumatismo o una úlcera de estómago provoca una fuerte hemorragia o cuando una diarrea grave drena los líquidos del organismo. El corazón bombea demasiada poca sangre en cada latido y, aunque intenta compensar la bajada de presión mediante un incremento del ritmo, no lo consigue: la presión arterial cae y los tejidos quedan sin alimento. Cuando se trata de un shock hipovolémico, del que se producen millares cada año, los médicos se esfuerzan por parar la hemorragia o la pérdida de otros fluidos mediante la transfusión de sangre, la infusión de una solución salina o ambas medidas a la vez, para compensar así el volumen del líquido que el organismo ha perdido. Los investigadores buscan nuevas formas para detener la hemorragia: aplicar una sustancia que aumente la coagulación o utilizar sucedáneos de la sangre si falta ésta en cantidad suficiente.
El shock cardiogénico se presenta cuando el corazón deja de bombear adecuadamente. Si un trombo bloquea una arteria coronaria e impide que el oxígeno llegue al músculo cardíaco, se produce un infarto: parte del miocardio queda privado de oxígeno y necrosa; dejando al corazón incapaz de funcionar con normalidad. También, una arritmia –un latido demasiado rápido, demasiado lento o no sincronizado- o el fallo de una válvula del corazón, que no se cierra bien, desencadenan un shock cardiogénico. En los aproximadamente 280.000 casos de shock cardiogénico que ocurren cada año en los EE.UU., los médicos a menudo recurren a alguno de estos tratamientos: administrar medicamentos para aumentar la capacidad contráctil del miocardio, reemplazar una válvula (por una válvula mecánica o una procedente de cerdo) o implantar un desfibrilador, un mecanismo que emite una descarga eléctrica al corazón, manteniendo así el bombeo coherente del músculo cardíaco. Si todo eso falla, se opta por el trasplante de corazón.
El tercer tipo de shock, el más habitual, es el vasodilatador. Se produce cuando un shock cardiogénico o hipovolémico se prolonga varios días. En esos casos, el shock podría persistir, aun cuando se haya estabilizado el corazón o se hubiera transfundido sangre. Pero la causa más frecuente de este tipo de shock es la sepsis, una infección grave en la que hongos o bacterias irrumpen en la sangre, desencadenando una respuesta inflamatoria. Los leucocitos y otros agentes del sistema inmunitario alteran la función de los tejidos en un combate desesperado contra la infección. La sepsis afecta cada año a unas 500.000 personas en los EE.UU.; alrededor de la mitad desarrollan un shock séptico y 125.000 mueren por su causa. El corazón no es aquí el culpable del shock, pues bombea un flujo elevado de sangre (la piel del paciente permanece caliente al tacto). La raíz del problema se encuentra lejos, en las arteriolas.
Desde hace tiempo, los expertos venían sospechando que una mayor comprensión de la disfunción de las arteriolas podría ayudar a mejorar el tratamiento del shock vasodilatador. En ese contexto, los esfuerzos empeñados en desentrañar el origen de las alteraciones de las arteriolas nos recompensaron, hace ahora poco más de seis años, con un descubrimiento inesperado.
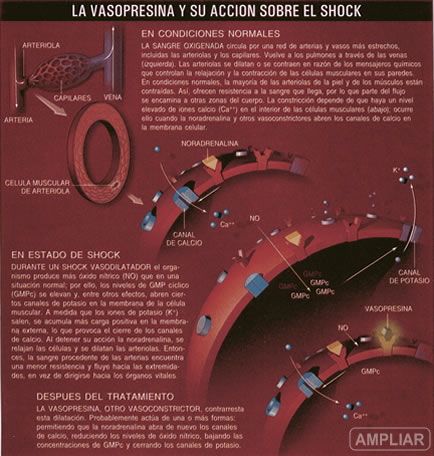
El comportamiento anómalo de las arteriolas arranca de muy atrás; mucho antes de que se asiente el shock. Al caer la presión arterial, lo primero que hace el organismo es intentar detener el shock mediante una respuesta compensadora, que se centra en las arteriolas. Estos tubos están rodeados por miocitos que se contraen o relajan, variando así el diámetro del lumen. En condiciones normales, la coordinación de las arteriolas resulta harto compleja; intervienen numerosos compuestos: noradrenalina, vasopresina, angiotensina II, dopamina y óxido nítrico, entre otros. Cuando la presión arterial cae, algunos de estos factores entran en juego: la noradrenalina y la angiotensina II, que contraen los músculos de la arteriola, se segregan en el torrente sanguíneo; al propio tiempo, el organismo detiene la secreción del péptido natriurético atrial, una proteína que provoca la relajación de los músculos de las arteriolas y, con ello, la dilatación de éstas. Si tales procesos tienen éxito, las arteriolas de la piel y de ciertos músculos no esenciales se contraen, de forma que la sangre que llega encuentra mayor resistencia y, por tanto, se desvía hacia órganos vitales como el cerebro. Para visualizarlo, imaginemos una manguera con una bifurcación: si uno de los brazos se contrae, presión y flujo aumentan en el otro. Eso es precisamente lo que sucede en las arteriolas.
Caída de la resistencia
Pero si, por alguna razón, determinadas arteriolas dejan de contraerse, la sangre no encuentra la resistencia necesaria para dirigirse y llegar hasta las regiones vitales. Aunque parezca extraño, los pacientes que sufren un shock vasodilatador tienen niveles altos de noradrenalina y angiotensina II, lo que da a entender que el problema no reside en la ausencia de señales de constricción. La experiencia clínica apoya también esta hipótesis: los pacientes que reciben estos dos compuestos, apenas mejoran. Este resultado, un tanto enigmático, llevó hace tiempo a muchos expertos a la conclusión de que algo malo ocurría en las células musculares de las arteriolas, pues los miocitos no respondían a sus señales habituales.
A mediados de los años ochenta del siglo pasado, sin embargo, se descubrió que la responsabilidad de la disfunción no recaía tanto en las células musculares cuanto en la acción de cierto agente dilatador. El más prominente de cuantos operan en nuestro organismo es el óxido nítrico, molécula sencilla aunque de efectos muy diversos [véase “Funciones biológicas del óxido nítrico”, por Solomon H. Snyder y David S. Bredt; INVESTIGACIÓN y CIENCIA, julio de 1992]. Dichos hallazgos dejaron claro que las infecciones que causan sepsis -neumonía y meningitis, entre otros- determinan también que las células aumenten la síntesis de óxido nítrico. Esta noticia se recibió con entusiasmo. Se ideó un ensayo clínico para someter a prueba un inhibidor del óxido nítrico. Se esperaba que, una vez que el dilatador hubiera desaparecido de la escena, los constrictores (noradrenalina y angiotensina II) conseguirían realizar su función. El nuevo tratamiento provocó una auténtica tragedia. Hubo más bajas de las esperadas y se multiplicaron las complicaciones. El óxido nítrico desempeñaba en el organismo funciones tan diversas y desconocidas, que su inhibición desencadenó problemas graves e imprevistos.
Así las cosas, en 1992 descubrimos una vía alternativa para contraer las arteriolas durante un episodio de shock vasodilatador. Todo empezó en una sesión de reflexión conjunta sobre el funcionamiento de la membrana celular. En toda membrana celular existe una diferencia de potencial eléctrico: la carga en la pared interior de la membrana es distinta de la del exterior. Ello se debe, sobre todo, a que los iones potasio dotados de carga positiva residen en el interior celular, junto con todos los tipos de iones dotados de carga negativa, si bien tienden a escapar hacia el exterior, determinando con ello que la parte externa de la membrana adquiera mayor carga positiva que la interior de la misma [véase “La técnica del pinzamiento de membrana”, por Erwin Neher y Bert Sakmann; INVESTIGACIÓN y CIENCIA, mayo de 1992].
Las células musculares de las arteriolas utilizan esta diferencia de potencial eléctrico para regular la entrada de iones calcio a través de canales de calcio, que intervienen en la constricción. Si en el exterior de la membrana se acumula más carga negativa que en el interior, los canales de calcio se abren en respuesta a la noradrenalina o angiotensina II; el calcio se precipita hacia el interior de la célula. Esta se contrae entonces. Si, por el contrario, el exterior de la membrana adquiere más carga positiva que el interior, se cierran los canales de calcio, pese a las exigencias de las hormonas vasoconstrictoras. A medida que los niveles de calcio en el interior de la célula disminuyen, la célula muscular se dilata. Por consiguiente, y en punto a la constricción, la diferencia de potencial eléctrico determina la respuesta de los canales de calcio a las hormonas.
El comportamiento de los músculos de las arteriolas viene, pues, pautado por los canales transportadores de calcio. Pero el flujo de iones calcio depende de los canales de potasio para controlar adecuadamente la polarización de la membrana. Dichos canales están, a su vez, regulados por diversos compuestos, entre ellos el trifosfato de adenosina (ATP), una forma de energía celular generada en el metabolismo aer6bico de los nutrientes. Cuando los niveles de ATP disminuyen, se abren ciertos canales de potasio para dar paso al flujo de potasio hacia el exterior de la célula. Así, en la membrana externa se acumula una carga positiva extra, los canales de calcio se cierran y la célula se relaja.
Nos propusimos averiguar si los niveles bajos de oxígeno que se daban en el shock reducirían los niveles de ATP, causando la relajación de las células musculares y la consiguiente bajada de la presión arterial. Con ese objetivo, administramos glibenclamida, un bloqueante de la actividad de los canales de potasio sensibles al ATP. En efecto, se elevó la presión arterial. Este mecanismo explicaba por qué la administración de noradrenalina o angiotensina II fracasaba a la hora de aumentar la constricción: tales compuestos resultan ineficaces si los canales de potasio se encuentran abiertos.
Sin embargo, a imagen de lo descrito antes a propósito del inhibidor del óxido nítrico, la glibenclamida complicaba la situación. Su efecto fue de corta duración; el fármaco provocaba un descenso del nivel de azúcar en sangre cuando se administraron las dosis elevadas necesarias para revertir el shock. (A niveles más bajos, la glibenclamida se usa para tratar la diabetes, puesto que aumenta la actividad del páncreas en la liberación de insulina.) Fueron tiempos de frustración. Sabíamos de la importancia de los canales de potasio regulados por el ATP , de la relevancia del óxido nítrico. Pero no acertábamos a regularlos sin dañar otras zonas.
Un enfoque nuevo
Hasta que en 1997 nuestro trabajo dio un giro a raíz de un hallazgo fortuito. Asistíamos a un paciente que sufría una hemorragia esofágica, quien más tarde desarrolló una infección grave. Cuando ingresó, se le administró vasopresina para contraer los vasos del esófago y detener así la hemorragia. Se conocía bien la eficacia de esa hormona en la constricción de las arteriolas: actuaba en todo el organismo cuando la hipófisis la liberaba en respuesta a una presión arterial baja. Pero los estudios clínicos habían demostrado ya que, cuando se aplicaba en terapia, sólo resultaba eficaz en los vasos del esófago. Por tanto, no esperábamos ningún efecto sobre la presión arterial de nuestro paciente. Ante nuestra sorpresa, cuando retirábamos la vasopresina descendía la presión arterial del enfermo, pero al volver a administrarla, la presión arterial subió. Tal vez, pensamos, la infección lo habría hecho más sensible a la hormona.
¿Era pura carambola o había algo detrás? Para averiguarlo, necesitábamos un paciente con shock séptico y actuar con cautela en la dosis, guiados por el viejo principio deontológico: primum non nocere (“en primer lugar, no hacer daño”). Cuando se presentó la ocasión, le administramos al paciente en estado de shock séptico una décima parte de la cantidad que habíamos aplicado al enfermo con hemorragia esofágica, esperando ver sus efectos a medida que incrementábamos la dosis poco a poco. Ante nuestra sorpresa, su presión arterial se elevó drásticamente. La investigación ulterior reveló que los niveles de vasopresina en este y otros pacientes de shock séptico eran muy bajos, contra lo que parecía lógico, a saber, que el organismo produciría vasopresina para intentar remontar la presión arterial.
Nos inquietaba, de entrada, porqué los pacientes con shock vasodilatador sufrían tal deficiencia en vasopresina. En trabajos posteriores demostramos que, en el comienzo del shock -no importaba cuál fuera el desencadenante de éste-, los niveles de vasopresina se elevaban con desmesura. Pero al cabo de unas horas, la vasopresina caía. Ocurría que las reservas se liberaban en el comienzo del shock; la hormona se degradaba en el torrente circulatorio y los niveles de vasopresina tardaban en restablecerse. Reparamos entonces con sendos artículos, que habíamos dejado de lado porque todo el mundo habría concluido que la vasopresina no elevaba la presión arterial; en ellos se afirmaba que la vasopresina reducía los efectos dilatadores del óxido nítrico en las arteriolas y bloqueaba los canales de potasio sensibles al ATP, permitiendo la apertura de los canales de calcio y la contracción de la célula.
Desde esos primeros hallazgos, se ha examinado la vasopresina en 10 estudios, acometidos en diferentes lugares del planeta. Se ha comprobado que restaura la presión arterial de forma fiable, sin efectos secundarios significativos. Desde entonces, la restauración de la presión arterial ha salvado a muchos otros enfermos de la guadaña del shock. Hoy, son muchos los hospitales que recurren a la vasopresina. Se ha puesto en marcha una prueba multicéntrica con pacientes sépticos para determinar, con mayor grado de certeza, si el restablecimiento de la presión arterial logrará menguar los síntomas y muertes relacionados con el shock. Por fortuna, la síntesis de vasopresina no está patentada, lo que significa que su producción no requiere costes elevados.
La vasopresina no constituye la única línea de investigación para afrontar el shock. En años recientes, se han identificado componentes de la cascada inflamatoria desencadenada por la sepsis, que desemboca en shock. Se trabaja en la síntesis de anticuerpos –como el INNO 202- y otros compuestos que bloquean algunos de tales elementos de la respuesta inflamatoria. También se estudia el papel de los esteroides en el freno de dicha reacción en determinados pacientes. Se espera que estas líneas de investigación den lugar a tratamientos eficaces contra la sepsis y el shock. Ver cómo un hallazgo casual servía para trenzar los cabos sueltos de los mecanismos celulares y moleculares de la constricción, la dilatación y el shock ha constituido para los autores una experiencia apasionante. Pero contemplar cómo todo este conocimiento se traducía rápidamente a la práctica clínica y en tantos lugares ha sido aún más gratificante.
Los autores
Donald W. Landry y Juan A. Oliver enseñan en la facultad de medicina de la Universidad de Columbia. Doctorado en química orgánica por la Universidad de Harvard y experto en síntesis enzimática artificial, Landry dirige las áreas de nefrología y terapéutica experimental. De origen español, Oliver se doctoró en medicina por la Universidad de Barcelona, en su Cataluña natal. Tras completar su investigación posdoctoral en Harvard, entró en el claustro docente de la Universidad neoyorquina de Columbia.
Bibliografía complementaria
VASOPRESSIN DEFICIENCY CONTRIBUTES TO THE VASODILATION OF SEPTIC SHOCK. Donald W. Landry et al. en Circulation, vol. 95, n.º 5, págs. 1122-1125; 4 de marzo, 1997.
THE PATHOGENESIS OF VASODILATORY SHOCK. Donald W. Landry y Juan A. Oliver en New England Journal of Medicine, vol. 345, n.º 8, págs. 588-595; 23 de agosto, 2001.
Resumen Tratamiento del shock
Cada año, unas 500.000 personas en los EE.UU. entran en estado de shock por causas muy diversas, entre ellas la sepsis, una infección bacteriana masiva. Para la mitad de estos pacientes, el shock resulta letal.
La búsqueda de tratamientos eficaces ha resultado harto difícil. Varias líneas de investigación y moléculas candidatas a convertirse en fármacos han fracasado.
Un hallazgo casual nos ha conducido a la vasopresina. Tradicionalmente utilizada para prevenir hemorragias en el esófago, esta hormona se ha mostrado muy eficaz en el tratamiento del shock
|
|


