Problemas
en el citodiagnóstico de líquidos de punción
Valor del AgNOR
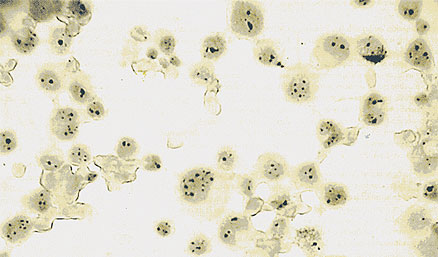
AgNOR en células provenientes
de un líquido de punción positivo
La Citología se enfrenta en
ocasiones con materiales que son un verdadero desafío aún
para un observador experimentado. Un ejemplo de este tipo de muestras
son los líquidos de punción, que debido a las características
propias del material ( células desprendidas de membranas
flotando en el líquido contenido en las cavidades serosas)
pueden mostrar alteraciones celulares de difícil interpretación.
Frecuentemente la producción de derrames en dichas cavidades
se debe a un tumor maligno metastático y en menor grado a
un tumor primitivo de la serosa (mesotelioma). La evaluación
citológica de muestras coloreadas con Papanicolaou y Giemsa
puede llegar a carecer en muchos casos de la exactitud requerida
para establecer un citodiagnóstico correcto.
Teniendo en cuenta lo importante del resultado del examen de estos
líquidos, ya que el informe decidirá en la mayoría
de los casos la conducta a seguir; existe gran preocupación
para aumentar la sensibilidad y especificad del diagnóstico
citológico. Lo primero se refiere a evitar que se informen
negativas muestras con células neoplásicas (falsos
negativos), y lo segundo a que se consideren como malignas células
que sólo presentan cambios reactivos (falsos positivos).
El Comité de Redacción de Acta
Bioquímica Clínica Latinoamericana ha seleccionado
este artículo publicado en la Revista DByM – Diagnóstico
Bioquímico y Molecular, Año IV, Nº 5 - 2006,
para su difusión a través de FABA Informa
Dra. Adriana Esther Rocher
Dr. Luis Alberto Palaoro
Sección Citología, Departamento
de Bioquímica Clínica, Facultad de Farmacia y Bioquímica,
Hospital de Clínicas, UBA.
La zona gris de los líquidos de punción
Los materiales con escasas células neoplásicas pueden
resultar un gran problema para la observación citológica,
pues éstas pueden pasar inadvertidas, sobre todo si se acompañan
con elevado número de células benignas.
El resultado sería un informe “falso negativo”,
situación muy poco frecuente en el citodiagnóstico
de las efusiones. Lo inverso ocurre con mayor frecuencia, y se debe
principalmente a la interpretación errónea de células
benignas de origen mesotelial como malignas, cuando dichas células
muestran cambios morfológicos propios de una elevada reactividad,
como se da en reacciones proliferativas del mesotelio como respuesta
a estímulos inflamatorios.
También las células que flotan durante mucho tiempo
en los líquidos de derrame desarrollan cambios pre-necróticos,
que a veces son indistinguibles de alteraciones por cáncer,
lo que conduciría a los “falsos positivos”.
En todos los casos descriptos se produce un error en el citodiagnóstico,
que dependerá además, en cierta medida, de la experiencia
del observador.
Pero ni el más experimentado citólogo puede evitar
en su estadística esta “zona gris”, dudosa, de
diagnóstico incierto1.
El factor humano explica porqué las sensibilidades informadas
en el diagnóstico citológico de los líquidos
de punción varíen tanto de un grupo de investigación
a otro.
¿Puede disminuírse la
zona gris?
Numerosos intentos se han desarrollado en el transcurso de los años
con el propósito de aumentar la sensibilidad del citodiagnóstico.
Los más antiguos fueron los tradicionales métodos
citoquímicos, como la reacción de P.A.S. para investigar
polisacáridos provenientes de ciertos tipos de adenocarcinomas
secretores.
Posteriormente se incorporaron técnicas como la inmunomarcación,
que con alta sensibilidad puede detectar la presencia de ciertas
proteínas relacionadas con procesos neoplásicos en
las células de los líquidos sospechosos2.
Así, el antígeno carcinoembrionario (CEA) y el antígeno
epitelial de membrana (EMA) se revelan en la mayor parte de los
adenocarcinomas metastáticos de serosas.
El CEA ofrece una ventaja extra, pues es negativo en los mesoteliomas
malignos, que son tumores primitivos de serosas, a veces de difícil
diferenciación morfológica con un tumor metastático3.
Pese al enorme número de anticuerpos monoclonales desarrollados
para utilizarse como técnica auxiliar en la diferenciación
entre células malignas y reactivas en efusiones, existen
controversias por resultados contradictorios en muchos de ellos,
lo que naturalmente limita su aplicación en los casos de
rutina4. Otro problema que “surge al intentar utilizar la
metodología de inmunomarcación es el alto costo de
los anticuerpos y del sistema de revelado, especialmente en nuestro
país, donde todos estos reactivos deben ser importados.
El estudio de la Ploidía (contenido de ADN de las células)
significó una gran contribución a la diferenciación
de poblaciones diploides (células reactivas) y aneuploides
(neoplásicas), pero la implementación de esta técnica
requiere coloraciones especiales para ADN (coloración de
Feulgen) y un programa de computación que permita la medida
del contenido de ADN de 400 núcleos, lo que implica tecnología
costosa, consumo de tiempo y personal adiestrado5.
En los últimos años se ha estudiado la aplicación
de una técnica que revela las proteínas no histonas
asociadas a la zona del organizador nucleolar (NOR), utilizando
sales de plata.
Por este motivo se la denominó AgNOR6.
AgNOR y nucleolo
El conjunto de genes que transcriben RNA ribosomal se encuentra
en las constricciones secundarias de los cromosomas 13, 14, 15,
21 y 22. El tamaño del nucleolo varía de acuerdo a
la necesidad de la célula de generar ribosornas, y como consecuencia
incrementa la producción de proteínas.
El número y tamaño de los NOR refleja la actividad,
proliferación o transformación de las células.
Podría pensarse que una coloración morfológica
del nucleolo nos daría información suficiente sobre
la capacidad de proliferación de una célula, y, sin
embargo, muchos ejemplos muestran que esta relación no siempre
se cumple. Basta mencionar que células neoplásicas
en necrosis suelen tener grandes nucleolos como consecuencia de
un proceso degenerativo, no como índice de su capacidad proliferante.
Por esto se hace necesario una técnica que permita una medida
indirecta pero objetiva de la capacidad de división celular.
Se ha demostrado que el tamaño nucleolar y la actividad de
la RNA polimerasa I en líneas celulares neoplásicas
humanas están en relación inversa al tiempo de duplicación
de dichas células7. Estos hechos apoyan la idea de la medición
del área nucleolar o el recuento de las partículas
de AgNOR como parámetros de proliferación celular.
Las células exfoliadas de serosas presentan nucleolo visible:
las mesoteliales normales tienen nucleolo pequeño y único,
las reactivas pueden aumentar el número de dicha estructura
y las adenocarcinomatosas se caracterizan por sus nucleolos grandes
y en ocasiones múltiples, de manera que las efusiones son
buenas candidatas para la aplicación de técnicas de
investigación de proteínas nucleolares8.
Técnica de AgNOR
Las muestras fijadas previamente en etanol 96° se colorean durante
25 minutos en la oscuridad con una solución coloidal de plata
obtenida mezclando dos partes de nitrato de plata 5% p/v en una
parte de gelatina al 1% p/v en ácido fórmico al 1%
v/v. Se lava 3 veces con agua deionizada, luego una vez con solución
de tiosulfato al 1% p/v durante 5 min, se deshidrata con xileno
y se realiza el montaje en bálsamo de Canadá.
Las partículas de AgNOR se observan como puntos negros dentro
de los núcleos.
Queda por decidir la forma de cuantificar los AgNOR. Si se elige
el recuento de las partículas (o puntos) de AgNOR, debe elegirse
sólo aquellas células que permitan contar todos los
puntos, eliminando del cálculo aquellas donde la superposición
o proximidad de los puntos impida su individualización. Se
cuentan 100 núcleos y se calcula el promedio de partículas
presentes (se utiliza el objetivo de inmersión).
Nuestro grupo de trabajo realizó la evaluación de
la manera descripta, llegando a establecer los siguientes valores
de referencia para la diferenciación entre células
reactivas y adenocarcinomatosas en líquidos de punción9:
•
Células mesoteliales reactivas: 4,88 partículas de
AgNOR por célula (desviación estándar: 1,50)
•
Células neoplásicas: 13,17 (desviación estándar:
3,88)
•
(diferencia entre las dos poblaciones: p<0,0001)
La otra forma de cuantificación de las proteínas
NOR es la medida de las áreas AgNOR en células reactivas
y neoplásicas (experiencia no realizada), pero esto implicaría
contar con un programa de computación que mida las superficies,
lo que no sería posible en muchos laboratorios.
Conclusiones
El recuento de partículas AgNOR en células de líquidos
de punción permite clasificar como benignos o malignos aquellas
muestras que resultan sospechosas al ser evaluadas sólo con
coloraciones morfológicas. Es una técnica fácil,
rápida, económica y no requiere instrumental especial,
pudiendo realizarse en cualquier tipo de laboratorio.
Como resultado de la evaluación de AgNOR, la que denominamos
“zona gris” disminuye notablemente, con el consabido
aumento de la sensibilidad y especificidad del método.
Referencias bibliográficas
1. Otherby
H, Nadjari B, Friegel P, et al: Diagnostic accuracy of effusion
cytology. Diagn Cytopathol 1999; 20:350-7.
2. Leong AS. Immunostaining of cytologic
specimens. Am J Clin Pathol 1996; 105:139-40.
3. Polit ti E, Kandaraki C, Apostolopoulou
C, Kyritsi T, Koutselini H. Immunocytochemical panel for distinguishing
between carcinoma and reactive mesothelial cells in body cavity
fluids. Diagnostic Cyt~pathology 2005; 32:151-5.
4. Shield PW, Perkins G, Gordon Wrigtht
R. Immunocytochemical staining of cytologic specimen: How Helpful
is it? Am J Clin Patho11996; 105: 157-62.
5. Kayser K, Blum S, Beyer M, Haroske
G, Kunze KD, Meyer W: Routine DNA cytometry of benign and malignant
pleural effusions by means of the remote quantitation server Euroquant:
a prospective study. J Clin Pathol 2000; 53: 760-4.
6. Ploton D, Menager M, Jeansson P.
Improvement in the staining and the visualisation of the argirophilic
proteins of the nucleolar organizer regions at the opticallevel.
Histochem J 1986; 18: 5-14.
7. Sujathan K, Kannan S, Raveendran
Pillai K. Significance of AgNor count in differentiating malignant
cells from reactive mesothelial cells in serous effusions. Acta
Cytol 1996; 40:724-8.
8. Carrillo R, Sneige N, EI-Naggar A.
Interphase Nucleolar Organizer Regions in the evaluation of serosal
cavity effusions. Acta Cytol 1994; 38: 367-72.
9. Rocher AE, Blanco
AM, Palaoro L. Utilidad de la técnica de AgNOR en la interpretación
de los derrames en cavidades serosas. Rev Med Chile 2000: 128:963-8.
|
|

