Detección de infección congénita por screening neonatal
Citomegalovirus (CMV) y pérdida auditiva
El Comité de Redacción de Acta Bioquímica Clínica Latinoamericana ha seleccionado este artículo publicado en INFORME ALAC. Ciencia y Ética – AÑO XV - Número 1 - 2010), para su difusión a través de FABA Informa
Edgardo Raúl Streitenberger1 / Ariel Ignacio Suárez1 / María Verónica Masciovecchio1 / Diana Laurnagaray2 / Ernesto Alda3
1. IACA Laboratorios, Bahía Blanca / 2. Hospital Privado del Sur, Servicio de Fonoaudiología, Bahía Blanca
3. Hospital Privado del Sur, Servicio de Neonatología, Bahía Blanca. E-mail: bmolecular@iaca.com.ar
INTRODUCCIÓN
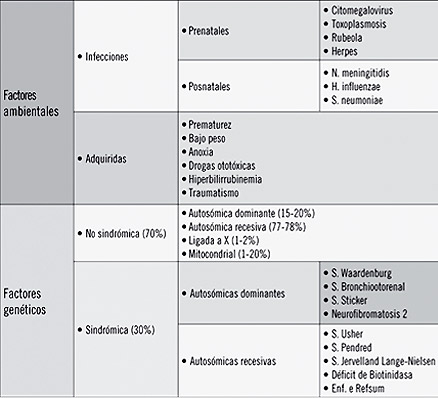
Las pérdidas auditivas pueden ser atribuidas a factores genéticos en el 50% de los casos y a factores ambientales en el 50% restante. Entre las causas genéticas las formas no sindrómicas (sordera como único hallazgo clínico), representan el 70% de los casos, mientras que las sindrómicas (sordera asociada a otros hallazgos clínicos) dan cuenta del 30% restante.1 Dentro de las causas ambientales, el citomegalovirus (CMV) es la principal causa de infección congénita con una prevalencia que va del 0,2 al 2,2%.2 Los bajos niveles socioeconómicos se asocian con seroprevalencias por CMV más elevadas y con una mayor incidencia de infección congénita. Sólo un 10% de los neonatos infectados presentará síntomas al nacimiento (Tabla 1).3 Las
infecciones virales como el CMV invaden las estructuras del oído interno dañando la audición. El daño es mayor cuando la infección ocurre en el período prenatal.4 Las pérdidas auditivas son una de las secuelas que suelen presentarse en los infectados con una prevalencia del 36% en el grupo de los recién nacidos sintomáticos y del 11% en los asintomáticos.5 Es altamente probable que un niño con infección por CMV sintomática desarrolle una hipoacusia bilateral neurosensorial de moderada a severa. Aunque la probabilidad no es tan alta en los casos de CMV asintomáticos, en los casos que adquieren hipoacusia, la severidad de la presentación es igual de intensa.6 Otro factor importante a tener en cuenta es que la forma de presentación de la pérdida auditiva es fluctuante, con distinto grado de severidad (profundas, severas o moderadas), progresiva y de comienzo tardío, lo que hace que estas pérdidas auditivas puedan escapar del screening universal.7
Un estudio longitudinal de investigación realizado por la Universidad de Alabama en Birmingham donde participaron 860 niños con infección congénita por CMV, demostró que el 7,4% de los asintomáticos desarrolló hipoacusia, contra el 40,7% de los sintomáticos. El porcentaje acumulativo de la pérdida sensorial en función de la edad indicó que la aparición de la disminución auditiva en el 100% de los casos ocurrió a los 15 años de edad. A los 6 años el 86,6% de los niños con CMV asintomáticos presentaban hipoacusia mientras que en el caso de los CMV sintomáticos el 95,5% la habían desarrollado en esa misma edad. Debido a la aparición tardía y progresión observada es necesario continuar el monitoreo en esta población.8
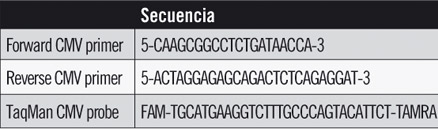
• Tabla 2. SECUENCIA DE CEBADORES Y SONDAS UTILIZADOS
Aunque la fisiopatología de la pérdida auditiva causada por CMV no es conocida totalmente, existe evidencia sobre una respuesta inflamatoria y un efecto directo en las células del oído interno. Las fluctuaciones y progresiones en la pérdida podrían deberse a una reactivación del virus y una reacción inmunológica a la infección. También se ha encontrado que el hidrops endolinfático es una secuela en algunos casos de infección CMV congénita.9
Debido a los avances en los conocimientos en genética así como a la disponibilidad de sofisticados estudios audiológicos que pueden utilizarse en recién nacidos, es que el estudio en conjunto de genetistas y audiólogos determina un diagnóstico preciso y un mejor tratamiento de los niños con pérdida auditiva. Un programa universal de detección e intervención temprana de hipoacusias que cuente con estudios audiológicos y moleculares vigentes, permite cumplir de manera óptima el objetivo de detectar tempranamente las hipoacusias infantiles.
OBJETIVOS
• Determinar la prevalencia de infección congénita por CMV en un servicio de neonatología de Bahía Blanca, Argentina.
• Identificar aquellos recién nacidos con riesgo de pérdida de audición, a fin de realizar un seguimiento de los mismos, una detección temprana de la patología y un tratamiento precoz para esos síntomas.
POBLACIÓN
Se analizaron 1020 muestras de sangre seca en papel de niños nacidos en el Hospital Privado del Sur, Bahía Blanca, Provincia de Buenos Aires, Argentina, entre septiembre de 2008 y junio de 2009. Las muestras fueron obtenidas por punción del talón entre el 3er y 5to día de vida. Este estudio fue aprobado por el Comité de Ética del Hospital y contó con el consentimiento de los padres involucrados. Estos niños nacidos en el Hospital, participan del Programa Nacional de Identificación e Intervención temprana de Hipoacusias (ley 25.415) de modo que todos los niños fueron evaluados con Otoemisiones acústicas por productos de distorsión. Antes de la realización de dicha prueba se explican sus características, en qué consiste el programa, los alcances y sus ventajas.
MATERIALES Y MÉTODOS
Extracción de ADN
La extracción de ADN viral se realizó según la técnica descripta por Barbi y Col.10 Sobre diez (10) trozos de sangre seca en papel de 1 mm2 se agregaron 45 uL de Medio Esencial Mínimo (MEM) y se sometió durante 60 minutos a 55 °C, 7 minutos a 1000 ºC y luego se enfrió a 4 °C. En el sobrenadante se encuentra el ADN extraído, el cual se conservó a –20 °C hasta su utilización.
Amplificación y detección de CMV
Se amplificó un segmento de 126 bp comprendido en la región Immediately Early Antigen (IEA). Para ello se utilizaron cebadores específicos (TABLA 2) y una sonda Taqman descriptos previamente por Kalpoe y Col.11 La amplificación y detección del ADN viral se realizó por PCR (Reacción en Cadena de la Polimerasa) en tiempo real utilizando un termociclador LightCycler 2,0 (Roche Applied Science, Penzberg, Alemania). La mezcla de reacción utilizada consistió en 4 ?L de Taqman Master (Roche), 500 nM de cada cebador, 100 nM de sonda y 5 ?L de templado. Las condiciones de ciclado fueron: 95 °C 10 minutos y 45 ciclos de 95 °C 1 s, 60 °C 20 s. Como control positivo se utilizó una mancha de sangre seca en papel obtenida a partir de una muestra de sangre a la que se le adicionó DNA de CMV provenientes de un stock viral.
EVALUACIÓN AUDIOLÓGICA
La evaluación audiológica se lleva a cabo mediante el protocolo de evaluación vigente para hipoacusias (Ontario Infant Hearing Protocol).
Luego de efectuar las Otoemisiones acústicas antes del alta hospitalaria todos los niños que fueron detectados positivos en el test molecular son derivados a realizar Potenciales Evocados Auditivos (por clicks y por frecuencias específicas: 0,5 kHz, 1 kHz, 2 kHz y 4 kHz) y luego se informa de manera oral y escrita el seguimiento que deberán realizar.
En los casos detectados con CMV la evaluación en el curso de este estudio consiste en Potenciales Evocados Auditivos cada seis meses hasta los 2 años, y uno en el tercer año de vida.
También se realiza audiometría por refuerzo visual durante el segundo año de vida y luego una audiometría tonal por juego desde los tres años y audiometría tonal convencional cuando la edad y maduración del niño lo permite hasta los 12 años.
Se efectúa timpanometría e impedanciometría para descartar patología de oído medio.
En caso de detectar hipoacusia neurosensorial, los niños serán intervenidos adecuadamente a cargo de un equipo especializado y evaluados con más frecuencia para monitorear la estabilidad de la hipoacusia, como así también su tratamiento.
RESULTADO
Seis de las 1020 muestras fueron positivas para CMV; de ellos sólo un neonato fue sintomático. Los 6 resultados positivos para CMV obtenidos a partir de sangre seca en papel fueron confirmados en una muestra de orina. Hasta el momento todos han realizado los primeros potenciales evocados y un niño presentó los umbrales para todas las frecuencias, descendidos (en oído derecho se hallaron los siguientes umbrales: 0,5 K en 65dB nHL; 1 K en 70dB nHL; 2 K en 65dB nHL y 4 K en 60dB nHL y en el oído izquierdo: 0,5 K en 70dB nHL; 1 K en 75dB nHL; 2 K en 60dB nHL y 4 K en 55dB nHL), con buena reproducibilidad, a pesar de una morfología de las ondas fisiológicas con muy baja amplitud. Volverá a estudiarse dentro de los seis meses a fin de determinar el tratamiento correspondiente.
CONCLUSIONES
Una de las limitaciones del screening universal es que no va a poder detectar pérdidas auditivas prelinguales que no se expresen al nacimiento. La infección congénita por CMV constituye la principal causa adquirida de pérdida auditiva de comienzo tardío. El screening universal permite identificar un 85% de las pérdidas auditivas neurosensoriales de niños en edad preescolar. El 15% restante correspondería a pérdidas auditivas de comienzo tardío. La implementación de este screening molecular como complemento al screening auditivo permitiría detectar estos casos de niños en riesgo.
La prevalencia de infección congénita por CMV fue del 0,6%. Dado que la adquisición de CMV está relacionada con las condiciones socioeconómicas y que la población estudiada corresponde aun nivel medio a alto, cabría esperar una prevalencia aún mayor si se estudiaran otros grupos de menores recursos.
De los niños con infección congénita sólo uno presentó sintomatología, el 84% restante no mostró al nacimiento ninguna alteración auditiva. Este último grupo es el que resultaría particularmente beneficiado con el diagnóstico precoz ya que, de no ser detectado al nacimiento, resulta difícil realizar luego un diagnóstico retrospectivo. El diagnóstico de infección por CMV dentro de los primeros días de vida permite el seguimiento audiológico, la detección temprana de pérdidas auditivas y una mejor recuperación de los niños afectados.
Desde el punto de vista técnico, el screening realizado presenta varias ventajas: utiliza la misma muestra de sangre seca en papel recolectada para el screening neonatal de enfermedades metabólicas y genéticas, y la muestra utilizada es de fácil almacenamiento, conservación y transporte. La utilización de PCR en tiempo real permitió acortar los tiempos de procesamiento y obtener una excelente sensibilidad y especificidad.
Una vez detectados los niños con hipoacusia, se interviene temprana y adecuadamente, permitiendo a los profesionales tomar ventaja de ese período crítico para la adquisición de lenguaje. El sistema nervioso se adapta y se re-organiza ante los estímulos que recibe. Esta forma de adaptarse se denomina “plasticidad del sistema nervioso” que constituye un período de suma importancia principalmente en los dos primeros años de vida.
Un programa de intervención temprana debe contar con la atención de un equipo de profesionales dedicados al tratamiento del niño con déficits auditivos: genetistas, médicos, médicos ORL, audiólogos y profesionales especialistas en terapia auditiva del lenguaje, todos trabajando en equipo y enfocados en la atención del niño y su familia.
Referencias
1. Genetics Evaluation Guidelines for the Etiologic Diagnosis of Congenital Hearing Loss. Genetic Evaluation of Congenital Hearing Loss Expert Panel. (2002) Genet Med 4(3):162-171.
2. Demmler GJ. (1991) Summary of a workshop on surveillance for congenital cytomegalovirus infection. Reviews of Infectious Diseases 1113:315-329.
3. Revello MG, Giuseppe G. (2002) Diagnosis and management of human cytomegalovirus infection in the mother, fetus and newborn infant. Clinical Microbiology Reviews 15(4):680-715.
4. Bess FH. (1977) Viruses that deafness. In Childhood deafness: causation, assessment and management. Ed. New York: Grune & Stratton, 53-59.
5. Fowler KB, Dahle AJ, Boppena SB. (1999) Newborn hearing screening: will children with hearing loss caused by congenital cytomegalovirus infection be missed? J Pediatrics 135:60-64.
6. Fowler K, McCoIlister F, Dahle A, Boppana S, Britt W, Pass R (1997). Progressive and fluctuating sensorineural hearing loss in children with asymptomatic congenital cytomegalovirus infection. J Pediatrics 130:624-630.
7. Nance WE, Lim BG, Dodson KM. (2006) Importance of congenital cytomegalovirus infections as a cause for prelingual hearing loss. Journal of Clinical Virology 35:221-225.
8. Dahle A, Fowler KB, Wright JD, Boppana SB, Britt WJ, Pass RF. (2000) Longitudinal Investigation of Hearing Disorders in Childrens with Congenital Cytomegalovirus. Journal of American Academy Audiology 11:283-90.
9. Huyguen OLM, Admiraal RJC. (1996) Audivestibular sequelae of congenital cytomegalovirus infection in 3 children presumably representing 3 symptomatically different types of delayed endoymphatic hydrops. Int J Pediatrics Otorhinolaryngol 35:143-154.
10 -Barbi M, Binda S, Primache V, Luraschi C, Corbetta C (1996) Diagnosis of congenital cytomegalovirus infection by detection of viral DNA in dried blood spots. Clinical and Diagnostic Virology 6:27-32.
11 -Kalpoe JS, Kroes ACM, de Jong MD, Schinkel J, de Brouwer CS, Beersma MFC, Claas ECJ. (2004) Validation of Clinica
|
|


