 |
|||
|
| ARG |
Un alga japonesa |
|
 Graciela Casas y Evangelina Schwindt Centro Nacional Patagónico, CONICET Características del alga El alga Undaria pinnatifida (Phaeophyceae) es una especie nativa de Japón, comúnmente llamada Wakame. Estas plantas son de color pardo oliváceo y de gran porte, pudiendo superar 1,60 m de largo. Se adhieren al fondo marino mediante una firme estructura de fijación que se denomina grampón (figuras 1a y 1b). La lámina de Undaria presenta una nervadura central y, cuando los individuos están reproductivamente maduros, desarrollan una estructura muy ondulada, entre el grampón y la base de la lámina llamada esporofilo que es característica de esta especie. Esta estructura puede alcanzar los 12 cm de ancho (figura 2, remitir al original*). Allí se generan millones de esporas, que luego de ser liberadas se asientan en el fondo del mar dando origen a una fase microscópica llamada gametofito. Es decir, el ciclo de vida de esta especie tiene dos fases, como se ve en el esquema de la figura 3: una macroscópica con ejemplares visibles a simple vista y una fase microscópica constituida por filamentos (gametofito). Estas algas alcanzan su mayor tamaño al finalizar el invierno y al comienzo de la primavera. En verano se deterioran y decoloran debido a las altas temperaturas del agua de mar en esta época del año, lo que, sumado al fuerte oleaje producido por los vientos y las corrientes marinas, hace que sean arrancadas y arrojadas sobre la playa. 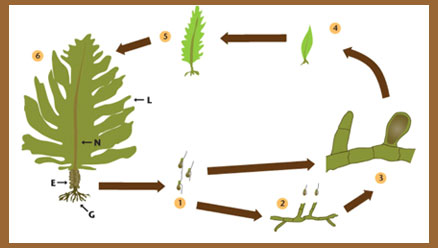 Figura 3. Ciclo de vida de Undaria pinnatifida. 1: Esporas móviles (zoosporas), 2: fase microscópica masculina liberando gametas, 3: fase microscópica femenina con una célula huevo, 4 y 5: desarrollo de la fase macroscópica, 6: ejemplar maduro. (Diagrama basado en un original de ML Piriz) Adaptación a diversas condiciones ambientales Temperatura La ecología de esta especie invasora estaría muy relacionada con la temperatura en el desarrollo de las diferentes fases de su ciclo de vida. En Japón, Undaria se desarrolla entre 4 y 28 ºC, un amplio rango de temperatura que provoca que la especie presente un comportamiento estrictamente anual, es decir nace, crece, se reproduce y muere todos los años, con una marcada estacionalidad en el reclutamiento de ejemplares jóvenes (el reclutamiento, un concepto básico en ecología, se refiere a la incorporación de nuevos individuos a la población de una determinada especie). Fuera de su área nativa, los estudios sobre la ecología del alga han mostrado que si bien hay desarrollo a temperaturas bajas (5 a 10 ºC), el óptimo ocurre entre 10 y 20 ºC, coincidiendo con el rango de temperaturas que se registra en la mayoría de los sitios invadidos por Undaria. El rango de temperaturas del mar es poco amplio en algunas regiones como en la Patagonia, lo que incidiría en que la especie presente un reclutamiento constante a lo largo del año, sugiriendo que a diferencia de lo que ocurre en Japón, incluso en los meses más fríos del año podría haber esporas viables en la columna de agua. Salinidad Aunque el valor de salinidad necesario para el crecimiento óptimo de Undaria está por sobre 27‰, se ha observado que esta especie puede prosperar en aguas con salinidades menores. Se han establecido poblaciones de Undaria en sitios con muy bajas salinidades como Venecia (20‰), Nueva Zelanda (22-23‰) y España (27‰), algo que indica una buena tolerancia fisiológica a aguas salobres. Luz Las plantas de Undaria se distribuyen a lo largo del gradiente de profundidades, según la transparencia del agua. Es decir, con aguas más transparentes la profundidad a la cual pueden crecer es mayor y se ubican cerca de la superficie en aguas más turbias. De este modo, las plantas de Undaria en Golfo Nuevo pueden observarse desde la superficie del mar hasta profundidades a veces mayores a los 20 metros, característica que presentan pocas especies de algas nativas. Pero en áreas menos profundas, debido a que fisiológicamente los ejemplares juveniles de Undaria tienen mejor tolerancia a bajos niveles de irradiación, son competidores dominantes frente a otras algas nativas. A su vez, los gametofitos o fase filamentosa microscópica actúan como verdaderas estructuras de resistencia y son capaces de sobrevivir en la oscuridad por varios meses. Dispersión mundial Undaria ha sido introducida tanto accidental como intencionalmente en distintas regiones del mundo, como puede verse en la figura 5 (remitir al original*). Su aparición en Europa ocurrió en 1971, cuando fue introducida involuntariamente en el Mediterráneo con las semillas de ostra (individuos juveniles muy pequeños) importadas de Japón para cultivo. En 1983 fue introducida deliberadamente en las costas de la Bretaña francesa sobre el Atlántico. También a Galicia (España) ingresó en 1990 acompañando semillas de ostras que se cultivan en las rías gallegas. Posteriormente se la registró en la laguna de Venecia (Italia) en el mar Adriático y en el puerto de Gijón (España) sobre el mar Cantábrico; habría ingresado adherida a los cascos de embarcaciones deportivas, dado que este puerto recibe una numerosa flota francesa de ese tipo. Teniendo en cuenta la presencia de densas poblaciones en Bretaña (Francia) y el intenso tránsito de barcos y transbordadores que continuamente cruzan a Gran Bretaña, la introducción de Undaria en las costas del sur de Inglaterra hacia 1995 no fue un hecho inesperado, así como su dispersión por las costas del norte de Europa hacia Holanda y Bélgica. Incluso existe la posibilidad de que se disperse más allá de las costas de Gran Bretaña hacia el Mar del Norte. Otros sitios del Hemisferio Norte donde recientemente se la ha registrado fueron California en 2002 y México en 2004. Si bien Undaria es originaria de Japón, es cultivada por ser una especie comestible desde hace largo tiempo en las costas de Corea y China. También se la menciona cerca de Vladivostok en Rusia. En el Hemisferio Sur los primeros registros de Undaria pinnatifida ocurrieron en Nueva Zelanda en 1987, luego en Tasmania en 1990 y en Australia continental en 1998. Un hecho significativo es que en todos estos sitios donde Undaria fue introducida, el comienzo de la invasión se produjo en área de puertos. En la Argentina había sido registrada en 1992, el único caso hasta el presente en las costas atlánticas del continente americano. Desde el momento de su introducción en el país, Undaria se dispersó relativamente rápido. En el Golfo Nuevo recorrió 172 kilómetros en diez años (figura 5). En Francia, diez años después de su descubrimiento, fue encontrada a 70 kilómetros al sudeste y después de diecisiete años el límite estaba a 130 kilómetros al sur del punto de origen. Paralelamente a su dispersión dentro de los límites de Golfo Nuevo, las poblaciones aumentaron su densidad y esto podría haber generado un área donante desde la cual la especie se pudiera propagar en forma de esporas, fragmentos, etcétera. Es así como podría haberse dispersado a otras localidades portuarias hacia el sur de la provincia de Chubut, doce años después también llegó a Puerto Deseado en la provincia de Santa Cruz, distante unos 760 kilómetros hacia el sur (figura 6, remitir al original*). La facilidad de dispersión de Undaria por el mundo podría deberse a la capacidad de latencia que poseen sus estructuras reproductivas microscópicas, las cuales pueden permanecer en ese estado por varios meses. Esta condición podría haber favorecido su resistencia durante el transporte dentro de los tanques de agua de lastre de las embarcaciones. Impacto ambiental Con la alteración del hábitat, las invasiones biológicas son consideradas la segunda causa de cambio de la biodiversidad (otras causas son los dragados, la extracción de arena, la contaminación, la pesca, etcétera), por esta razón la Convención de Biodiversidad firmada en Río de Janeiro en 1992 recomendó la erradicación y/o control de las especies introducidas. Muchas especies introducidas alteran procesos ecológicos y pueden ser causantes de extinciones de las especies nativas. Sin embargo, en los ambientes marinos existen pocos casos demostrados de extinciones actuales causadas por la introducción de especies, no necesariamente porque no ocurran, sino por el escaso conocimiento que se tiene de la biodiversidad marina. En el caso de las comunidades algales la competencia por luz o sustrato puede ser intensa y acarrear la exclusión parcial o incluso la desaparición total de especies nativas. Estudios experimentales en el campo han mostrado que la presencia de Undaria impacta negativamente sobre la diversidad de algas marinas. Esto podría ocurrir debido a que las poblaciones de esta especie presentan un gran desarrollo en altura, especialmente al final del invierno y en primavera. Ello, sumado a la abundancia en número de individuos, produciría un significativo sombreado del fondo marino. Por otro lado, las estructuras de fijación del alga (grampones) pueden superponerse y enredarse entre sí cubriendo el fondo y reduciendo así el espacio disponible para el desarrollo de otras especies sedentarias. Desde la introducción de Undaria en Golfo Nuevo, el paisaje submarino ha cambiado dramáticamente. Undaria ha demostrado poseer la capacidad de colonizar tanto sustratos artificiales (barcos hundidos, boyas, pontones, redes, cuerdas y pilotes) como arrecifes naturales. En la costa patagónica, los arrecifes están constituidos por rocas que se extienden desde la playa hasta el submareal (más allá de las mareas más bajas) donde nunca son descubiertos por el agua durante las mareas bajas. La biodiversidad de estos arrecifes podría verse impactada por la presencia de Undaria. En estos arrecifes rocosos se forman cuevas y aleros que son el hábitat de peces que viven allí habitualmente, por lo tanto, la presencia de Undaria podría producir fluctuaciones en su abundancia (figuras 7a y b, remitir al original*).). Esta hipótesis está siendo estudiada mediante el contraste de los cambios en la abundancia de peces también en arrecifes no colonizados por Undaria. Habitualmente la mayoría de las algas son desprendidas en verano y arrojadas por las mareas a las playas, fenómeno conocido como arribazón (figura 8, remitir al original*). En el caso de Undaria, las grandes plantas son removidas arrancando sus estructuras de fijación o grampones y al soltarse arrastran con ellas fauna y flora marina, produciendo una remoción y alteración en los fondos rocosos. Si Undaria se convirtiera en una nueva fuente de alimento para la fauna nativa, su introducción podría generar otros cambios ecológicos. Un pequeño caracol marino, el gasterópodo Tegula patagonica, y los erizos de mar Arbacia dufresnii y Pseudechinus magellanicus son reconocidos como potenciales herbívoros y viven habitualmente con Undaria. Sin embargo, y aunque existen resultados preliminares, aún no se ha verificado el impacto regulador que podrían tener estos organismos sobre las algas y si las poblaciones de estos invertebrados han aumentado su densidad desde la aparición de Undaria en Golfo Nuevo como un recurso nuevo y abundante. Impacto económico Otro aspecto importante en el estudio de especies invasoras es el impacto económico que algunas pueden tener. En el caso de Undaria el riesgo se encuentra si se dispersa a otras áreas económicamente productivas por la explotación de otras algas. En este sentido, se han observado poblaciones de esta especie creciendo sobre praderas del alga productora de agar Gracilaria gracilis, ubicadas al sur de la bahía de Camarones. En esta zona se encuentran ubicadas las concesiones algueras que se dedican a la extracción de algas para su industrialización y comercialización. Más recientemente Undaria ha sido observada en la costa del golfo San José, una zona caracterizada por la explotación de moluscos bivalvos que son recolectados por pescadores artesanales. Si bien se están realizando tareas para conocer y eventualmente controlar su dispersión, es importante trabajar en la concientización de toda la población y el control estricto de la limpieza de las embarcaciones que ingresan al golfo para evitar nuevas reintroducciones. Si Undaria llegara a expandirse en el golfo San José como lo ha hecho en el Nuevo, el efecto negativo sobre las pesquerías artesanales podría ser de gran magnitud. Estas tareas de prevención no son sencillas ni económicas, y su óptima coordinación exige una planificación articulada entre los grupos de pescadores, las agencias y oficinas gubernamentales y no gubernamentales. Una de las actividades económicamente relevantes que se realizan en Golfo Nuevo es el buceo deportivo en los parques submarinos. Esta actividad está a cargo de empresas operadoras y si bien se realiza durante todo el año, tiene su mayor nivel en el verano. Como consecuencia de la presencia del alga Undaria la fisonomía de los parques submarinos se ve alterada, obligando a realizar continuamente tareas de limpieza y mantenimiento, principalmente previas a la temporada estival, lo cual implica costos adicionales. El mayor impacto en las playas de Golfo Nuevo lo producen las arribazones de Undaria. Diariamente la inmensa cantidad de algas depositadas en la playa tienen que ser retiradas, y en verano las playas deben ser limpiadas por razones de higiene, olores y de impacto visual en el turismo. Esta limpieza se realiza con topadoras y lo recolectado se retira de la playa con camiones (figura 9, remitir al original*), lo cual ocasiona una importante erogación económica al municipio local y por ende al contribuyente. El trabajo diario de las máquinas no sólo extrae las algas sino también gran cantidad de arena y con la arena van incluidos otros organismos, lo cual indudablemente estaría generando erosión e impacto ambiental en las playas. Las embarcaciones y el agua de lastre Se ha mencionado en diversas oportunidades a las embarcaciones como vector de transporte de especies exóticas. Desde tiempos históricos, los barcos han sido un transporte efectivo no sólo para seres humanos sino para animales, plantas y otros organismos. Como resultado de los movimientos humanos a través del mundo, sea por exploración, comercio o colonización, las especies han atravesado barreras biogeográficas naturales entre continentes y entre océanos. Este proceso ha ido llevando paulatinamente a una profunda alteración en la diversidad y la estructura de muchas comunidades marinas costeras. Hasta aproximadamente 1890 las embarcaciones eran construidas enteramente de madera. De este modo, mamíferos, plantas, aves, insectos y semillas fueron transportados acompañando a la arena y las rocas que constituían el ‘lastre seco’ que se utilizaba para darle estabilidad y equilibrio a las embarcaciones. A su vez, el exterior de los barcos estaba colonizado por organismos marinos como dientes de perro, moluscos, cangrejos y algas. Posteriormente las embarcaciones comenzaron a construirse de metal y por lo tanto el lastre seco fue lentamente reemplazado por agua, contenida en tanques especiales. No sólo cambió el tipo de lastre de las embarcaciones sino la tecnología naviera. Las embarcaciones comenzaron a ser más veloces, a recorrer en menor tiempo mayores distancias y a visitar una mayor cantidad de puertos. Por lo tanto, las oportunidades para nuevas introducciones de especies aumentaron considerablemente por la carga y descarga de agua en cada sitio. El agua de lastre, más allá de ser necesaria para la estabilidad del barco durante la navegación, constituye un mecanismo de transporte de enormes volúmenes de agua. La Organización Marítima Internacional estimó que para enero de 2008 la flota mercante mundial era de 50.500 barcos. Se considera que estas embarcaciones comerciales (que transportan más del 80% de las mercaderías del mundo) trasladan cada año un volumen de 3 a 10 billones de toneladas de agua (figura 10, remitir al original*) con una estimación de cerca de 7000 especies marinas, dulce acuícolas o estuariales. Debe tenerse presente que el agua de lastre es un transporte no selectivo, por lo tanto el agua bombeada en cada puerto contiene no sólo organismos animales y vegetales adultos y larvas, sino también virus y bacterias, muchas de ellas patógenas, como las del cólera y el botulismo. Las embarcaciones no sólo extraen y descargan agua en cada puerto que visitan, sino que además pueden transportar partículas de arena que ya en las cisternas sedimentan y pueden constituirse ambientes propicios para el desarrollo de organismos típicos de fondos blandos sedimentarios. Muchas especies exóticas podrían ser ecológicamente peligrosas cuando son liberadas en un ambiente no nativo. Por ejemplo, las floraciones de algas tóxicas llamadas ‘marea roja’ son un fenómeno natural que ha ocurrido históricamente, sin embargo, en las últimas décadas se han incrementado en frecuencia e intensidad y han ampliado su distribución geográfica, y están muchas veces asociadas con la presencia de especies foráneas, por ejemplo, en las aguas costeras de la Patagonia. Existe reconocimiento de que el agua de lastre transporta numerosas especies y del daño causado por las introducciones accidentales, y su manejo genera gran preocupación en todos los países. En mayor o menor grado se está trabajando para encontrar una solución a esta problemática económica, social y ambiental, en un plano de opinión diferente al de los intereses de la vasta industria marítima.  Figura 1a. Uno de los primeros ejemplares de Undaria pinnatifida, hallado por buzos en Golfo Nuevo (Chubut), en diciembre de 1992. La escala ubicada a la izquierda mide 20 cm. Foto G Casas. N: nervadura, L: lámina, EP, esporofilo, G: grampón. GLOSARIO - Agar. Forma parte de la pared celular de algunas algas rojas. Es utilizado como materia prima en la industria de la alimentación y en bacteriología. Tiene la particularidad de ser insoluble en agua fría pero soluble en agua hirviendo y solidificar a 36?C, por lo cual es utilizado en bacteriología para cultivos de bacterias presentes en el ser humano y como gelatina en alimentación. - Agua de lastre. Agua dulce o salada que se encuentra contenida en tanques especiales en las embarcaciones y que, al mantener el casco del barco relativamente sumergido, incrementa la estabilidad y maniobralidad durante los viajes. El agua es cargada y descargada en cada puerto, de acuerdo con la carga o descarga de mercancías de las embarcaciones en cada lugar. - Alga. Las algas son organismos vegetales que, salvo excepciones, son acuáticas tanto marinas como de agua dulce. Pueden ser unicelulares (de una sola célula) o pluricelulares (muchas células) formando tejidos. El término alga no es una clasificación científica, sino que se utiliza como generalización para denominar a estos vegetales en la descripción de los ecosistemas acuáticos. El estudio científico de las algas se llama ficología, una derivación del nombre del alga Fucus (del latín phycos: pasto marino o alga marina). - Arribazón. Es un fenómeno natural que consiste en el depósito en la costa de algas que fueron arrancadas por los movimientos del agua. También se lo conoce en otros países como algazo. - Esporofilo. Del griego sporos: semilla y pkyllon: hoja, fronda. Es la estructura o lámina especializada donde se forman unos receptáculos especiales llamados esporangios que contienen esporas. - Gametofito. Del griego gameto: gameta y phyto: planta. En el ciclo de vida de una planta, es el individuo en el cual se forman las gametas masculinas o las femeninas. - Grampón. Es la estructura de fijación de un alga, mediante la cual las algas de mayor porte se adhieren al sustrato, como las laminariales. Graciela N Casas Doctora en biología, Universidad Nacional del Sur. Profesional principal, CONICET graciela@cenpat.edu.ar Evangelina Schwindt Doctora en ciencias biológicas, Universidad Nacional de Mar del Plata. Investigador asistente, CONICET. |
|
| Subir | ^ |
 |
| Un alga japonesa en la costa patagónica |