| Pigmentos
que, expuestos a la luz, se tornan cáusticos y pueden combatir el
cáncer, la ceguera y las cardiopatías.
El Comité de Redacción de Acta Bioquímica
Clínica Latinoamericana ha seleccionado y adaptado este artículo
de Investigación y Ciencia (marzo de 2003) para su difusión
a través de FABA Informa
NICK LANE
Director de Adelphi Medi Cine, estudió bioquímica en
el Colegio Imperial de la Universidad de Londres. Su investigación
doctoral se concentró en los radicales libres y en la función
metabólica en transplantes de órganos.
La porfiria constituye un grupo heterogéneo
de trastornos afines en los cuales ciertos pigmentos llamados porfirinas
se acumulan en la piel, huesos y dientes.
Mientras los científicos se esforzaban en hallar remedios para
la porfiria, cayeron en la cuenta de que las porfirinas podrían
no constituir solamente un problema, sino convertirse también en
aliadas de la medicina. Si se inyecta porfirina en un tejido enfermo –en
un tumor canceroso, por ejemplo-, la porfirina puede ser activada mediante
luz con el fin de destruir ese tejido. El procedimiento se denomina terapia
fotodinámica (TFD); se ha desarrollado tanto, que ha pasado de
ser en los años setenta un tratamiento poco verosímil contra
el cáncer a erigirse ahora en un arma perfeccionada y eficaz contra
todo un abanico de trastornos, en particular para tratar la degeneración
macular y la miopía patológica, dos causas corrientes de
ceguera en los adultos. Entre las investigaciones en curso se encuentran
posibles tratamientos para la enfermedad de las arterias coronarias, sida,
trastornos autoinmunitarios, rechazo de transplantes y leucemia.
Mecanismos moleculares
Las sustancias que desempeñan un papel crucial en la porfiria y
en la terapia fotodinámica, se cuentan entre las más antiguas
e importantes de las moléculas biológicas. Orquestan los
dos procesos críticos de generación de energía en
los seres vivos: la fotosíntesis y la respiración aeróbica.
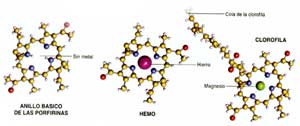
Las porfirinas constituyen una familia notable de compuestos íntimamente
relacionados, un curioso y colorido sistema de variaciones evolutivas
sobre un mismo tema. Todas las porfirinas comparten un anillo tetrapirrólico
plano (compuesto por carbono y nitrógeno) con un hueco central
adecuado para que un ion metálico, de hierro o de magnesio, se
alojen en él
(Fig. 1).
Estos átomos metálicos, cuando están correctamente
alineados en la férula de los anillos de porfirina, catalizan los
procesos de generación de energía fundamentales en biología.
La clorofila, el pigmento vegetal que absorbe la energía de la
luz solar en la fotosíntesis, es una porfirina, como lo es el hemo,
pieza clave de la molécula encargada del transporte de oxígeno
-la hemoglobina- y de muchas enzimas cruciales para la vida, entre ellas,
la citocromo-oxidasa (que en una etapa crítica de la respiración
celular, genera energía por transferencia de electrones al oxígeno).
La porfiria resulta de una alteración del mecanismo productor de
hemo en el organismo. Nuestro cuerpo sintetiza hemo y otras porfirinas
en una serie de ocho estadios coordinados, catalizados cada uno por una
enzima distinta. Al final, se aporta hierro para formar hemo. En la porfiria,
se omite uno de los pasos, lo que produce un exceso de los compuestos
intermedios generados en etapas anteriores de la secuencia. Nuestro organismo
no ha evolucionado para eliminar tales metabolitos intermedios, por lo
que, a menudo, los acumula en la piel. Estas sustancias intermedias no
lesionan la piel directamente, pero muchas sí lo hacen por vía
indirecta. Las porfirinas no metálicas (así como las metalo-porfirinas
que contienen metales que no interaccionan con el anillo porfirínico)
pueden resultar excitadas al recibir luz de ciertas longitudes de onda,
saltando sus electrones a orbitales más energéticos. Estas
moléculas pueden, entonces, transmitir su excitación a otras
moléculas que posean enlaces de tipos adecuados, el oxígeno
en particular, para producir oxígeno monoatómico y radicales
libres, aquél y éstas muy reactivos. Dicho con otras palabras,
las porfirinas no metálicas no son las agentes, sino las mediadoras
de la destrucción: catalizan la síntesis de formas tóxicas
del oxígeno.
Psoralenos
Las reacciones fotosensibles no son necesariamente perniciosas. Sus efectos
benéficos se conocen desde la antigüedad. En particular, algunos
frutos y semillas contienen psoralenos, compuestos fotosensibles (foto-sensibilizadores)
que, indirectamente, llevaron a la experimentación con porfirinas.
Los psoralenos se utilizaban, hace miles de años, en Egipto y en
la India para el tratamiento de enfermedades de la piel. A mediados del
siglo pasado los incorporó a la medicina moderna Abdel Monem El
Mofty, dermatólogo de la Universidad de El Cairo; empezó
a tratar a enfermos de vitíligo (trastorno que provoca la despigmentación
de la piel en manchas irregulares), y más tarde, a los enfermos
de psoriasis, valiéndose de psoralenos purificados y de luz. Al
ser activados por la luz, los psoralenos reaccionan con el ADN de las
células en proliferación, matándolas.
Aaron B. Lerner, de la Universidad de Yale, y Thomas B. Fitzpatrick, de
la Universidad de Harvard, quedaron impresionados por la potencia de los
psoralenos. En la década de los sesenta demostraron que los psoralenos
se activaban con radiación ultravioleta (UVA); posteriormente,
la terapia de psoralenos fue perfeccionada utilizando una lámpara
ultravioleta parecida a la que hoy se emplea en los solarios. Su método
fue conocido por la sigla PUVA (abreviatura de psoralenos con UVA) y es
en la actualidad uno de los tratamientos más eficaces para la psoriasis
y otras enfermedades de la piel.
¿Una forma de matar células cancerosas?
A comienzos del decenio de los setenta, el éxito de la PUVA dejó
impresionado a Thomas J. Dougherty, del Instituto Roswell Park del Cáncer,
en Buffalo. Se preguntó si una variante de ese tratamiento no podría
ser eficaz contra el cáncer. Los psoralenos activados pueden matar
células “descarriadas” y controlar la inflamación,
pero no son, en comparación con las porfirinas, fotosintetizadores
potentes. Si los psoralenos mataban células sueltas, ¿no
podrían las porfirinas devorar tumores completos? Su idea supuso
el inicio de la auténtica terapia fotodinámica, en cuya
aplicación ciertos fotosintetizadores catalizan la producción
de radicales libres de oxígeno. Se basó en trabajos anteriores,
que revelaron dos propiedades de interés médico de las porfirinas,
a saber: se acumulan selectivamente en las células cancerosas y
son activadas por la luz roja, que penetra más profundamente en
los tejidos biológicos que otras luces de longitud de onda más
corta, como la luz azul o la UVA.
Dougherty y sus colegas publicaron sus datos en 1975, en el Journal of
the National Cancer Institute. En los años siguientes refinaron
su técnica utilizando un láser de baja potencia para enfocar
luz roja sobre los tumores. Trataron por este método a más
de 100 enfermos, entre ellos, a mujeres con cáncer de mama y a
pacientes de cáncer de pulmón, de próstata y de piel.
Los resultados fueron alentadores, con una “respuesta parcial o
completa” en 111 de 113 tumores.
Pero el cáncer no se deja vencer tan fácilmente. Al ir aumentando
el número de médicos que probaban suerte con TFD, se multiplicaron
los inconvenientes. La afinidad de las porfirinas para con los tumores
resultó tener algo de ilusoria, pues las porfirinas son incorporadas
por cualquier tejido de crecimiento rápido, incluida la piel, lo
que ocasiona fotosensibilidad. Aunque los primeros pacientes de Dougherty
tuvieron sin duda cuidado de evitar el sol, alrededor del 40 por ciento
de ellos sufrió quemaduras y sarpullidos en la piel en las semanas
siguientes a la TFD.
Otra cuestión concernía a la potencia. Los primeros preparados
de porfirinas eran mezclas; su potencia terapéutica rara vez bastaba
para eliminar al tumor completo. Unas porfirinas no transmiten bien la
energía al oxígeno, mientras que otras sólo se activan
con luz que no puede penetrar en el tumor más allá de unos
cuantos milímetros. Algunos pigmentos biológicos habituales
de los tejidos, como la hemoglobina y la melanina, también absorben
luz; al hacerlo, pueden impedir que la porfirina llegue a activarse. Incluso
la propia porfirina puede provocar este problema si se acumula en concentraciones
tan elevadas, que absorba toda la luz en las capas superficiales del tumor,
impidiendo así la penetración hasta las más profundas.
Porfirinas Sintéticas
Muchas dificultades de éstas no pudieron resolverse sin el concurso
de especialistas de otras disciplinas. Fueron necesarios químicos
para crear porfirinas sintéticas, nuevas, de mayor selectividad
respecto de los tumores y de mayor potencia, que las activaran luces cuya
longitud de onda permitiera penetrar más profundamente en los tejidos
y tumores. (Para cada porfirina, la absorción y la activación
por luz se produce solamente a longitudes de onda- determinadas, por lo
que se buscan porfirinas que presenten máximos de absorción
a aquellas longitudes de onda que penetran bien en tejidos biológicos).
También fue necesaria la participación de físicos
para diseñar fuentes de radiación capaces de producir las
luces de longitud de onda específica para activar las nuevas porfirinas,
o que pudieran ser montadas en delgados endoscopios o catéteres,
o incluso implantadas en tejidos. Hizo falta recurrir a farmacólogos
que ideasen métodos para reducir el tiempo invertido por las porfirinas
en circular a través del torrente sanguíneo, con el fin
de minimizar los efectos secundarios de fotosensibilidad. Fueron precisos,
por último, expertos en medicina clínica, que creasen los
ensayos clínicos necesarios para demostrar un efecto y determinar
los regímenes de tratamiento óptimos.
El principio activo ideal no sólo debería ser potente y
selectivo hacia los tumores, sino también fragmentarse rápidamente
en componentes inocuos y excretarse del organismo.
El primer fármaco fotosensibilizador que cumplió los más
estrictos criterios de potencia y eficacia sin causar fotosensibilidad,
la verteporfina (Visudyne), fue aprobado en abril de 2000 no para el tratamiento
del cáncer, sino para evitar la ceguera. Conforme las teorías
iban convergiendo con la realidad, los investigadores cayeron en la cuenta
de que la TFD podría hacer algo más que destruir tumores.
Combatir la ceguera
Una de las cosas que podría hacer, por ejemplo, es combatir la
degeneración macular asociada a la edad (DMAE), la causa más
frecuente de ceguera en la población occidental, cada vez más
envejecida. La mayoría de quienes desarrollan degeneración
macular padecen una forma benigna y no llegan a perder la vista, pero
alrededor de la décima parte sufren de una variante mucho más
agresiva, llamada DMAE húmeda. En este caso, crecen por debajo
de la retina vasos sanguíneos anormales, con derrame, similares
a nodos de venas varicosas, que acaban lesionando la aguda visión
central necesaria para la lectura o la conducción. Con el progreso
de la enfermedad, la visión central queda obliterada, lo que hace
imposible reconocer los rostros de las personas o los detalles de los
objetos.
Enfrentados a tan deprimente situación, investigadores de la Universidad
de Harvard y de la empresa de biotecnología QLT, Inc., de Vancouver,
razonaron que la TFD podría detener el crecimiento de estos vasos
sanguíneos y retrasar, e incluso impedir, la ceguera. Si las porfirinas
tenían la propiedad de acumularse en cualquier tejido en rápida
proliferación -el problema mismo del cáncer- tal vez pudieran
acumularse también en los vasos sanguíneos subyacentes a
la retina.
La verteporfirina se acumula en los vasos retinianos anómalos con
notable rapidez: en un plazo de unos 15 minutos de ser inyectada por vía
intravenosa en el brazo. Al ser activada por luz láser roja, la
verteporfirina sella los vasos, dejando a salvo la retina superyacente.
Los posibles vasos que vuelvan a crecer pueden ser erradicados mediante
ulteriores tratamientos. En quienes sufren la forma más agresiva
de DMAE (con las lesiones más “clásicas”) la
verteporfirina redujo a la mitad el riesgo de pérdida moderada
o grave de la vista en un período de dos años. El efecto
se mantiene por lo menos durante tres o cuatro años: los enfermos
no tratados pierden tanta visión en tres meses como los tratados
con verteporfirina en tres años.
Otras líneas de tratamiento: fotoangioplastia
El éxito de los tratamientos oftálmicos con TFD ha inspirado
actividades investigadoras en otros campos, pero también ha puesto
de relieve los inconvenientes del tratamiento. En particular, ni siquiera
la luz roja penetra más de unos centímetros en los tejidos
biológicos. Esta limitación amenaza la utilidad de la TFD
en medicina interna: su importancia podría parecer meramente epidérmica.
No obstante, existen medios de llevar la TFD hacia el interior. Una idea
ingeniosa es la fotoangioplastia, aplicada ya en el tratamiento de la
enfermedad de las arterias coronarias.
La angioplastia coronaria es un procedimiento apenas agresivo para el
tratamiento de arterias afectadas de aterosclerosis. Se vale de un globo
diminuto para aumentar la luz de la arteria, con el fin de que las placas
ateroscleróticas no cieguen el vaso. La fotoangioplastia podría
obviar muchos de los problemas de la angioplastia tradicional, especialmente
la restenosis (reestrechamiento) de las arterias tratadas. El procedimiento
consiste en inyectar una porfirina en el torrente sanguíneo, esperar
a que se acumule en las paredes arteriales lesionadas e iluminar después
la arteria desde su interior, utilizando una fuente minúscula de
luz instalada en el extremo de un catéter. La luz activa la porfirina
de las placas y provoca la destrucción de los tejidos anormales,
sin afectar a las paredes sanas de la arteria.
Terapia fotodinámica e infecciones
La acumulación de porfirinas en las células activas y proliferantes
suscita la posibilidad de tratamiento de otras dolencias resultantes de
la activación o multiplicación celular anómala; por
ejemplo, en las enfermedades infecciosas. Las tentativas de tratamiento
de infecciones con los pigmentos habían fracasado por culpa de
un limitado efecto sobre las bacterias gram-negativas, que están
provistas de una pared celular compleja que les impide la absorción
de porfirinas. Una solución consistía en ligar un polímero
a la porfirina; por lo general, se emplea la polilisina, una cadena repetitiva
cuyo eslabón es la lisina, un aminoácido. El polímero
abre una brecha en la estructura lipídica de la pared bacteriana,
franqueándoles a las porfirinas la entrada en la célula.
Una vez en el interior, pueden ser activadas mediante luz para matar a
la bacteria. En estudios recientes realizados sobre animales con infecciones
bucales o heridas infectadas, la porfirina alterada demostró poseer
una (potente actividad antimicrobiana frente a un amplio espectro de bacterias
gram-negativas y gram-positivas. Al redoblarse la resistencia antibiótica,
la TFD específica podría convertirse en un recurso útil
para los médicos. (Ver
como actua la terapia fotodinámica)
Métodos fotodínamicos e inmunidad
Diversos métodos fotodinámicos asociados se basan .en el
descubrimiento de que las células inmunitarias activadas absorben
mayores cantidades de fotosensibilizadores que las células inmunitarias
quiescentes y los hematíes, lo que pone a las células inactivas
a salvo de daños irreversibles. En las infecciones no conviene
destruir células inmunitarias activas, pues, a la postre, son las
responsables de la respuesta del organismo ante la infección. En
estos casos, ir en contra de las células inmunitarias sería
atacar a nuestras propias fuerzas, y daría rienda suelta a la infección
para entrar a saquear nuestro organismo.
En el sida, sin embargo, lo contrario es cierto. El virus de la inmunodeficiencia
humana (VIH) infecta a las propias células inmunitarias. Poner
la diana en las células inmunitarias infectadas sería como
eliminar a los agentes dobles. En el laboratorio, las células inmunitarias
infectadas por VIH incorporan porfirinas, volviéndose de este modo
vulnerables a la fototerapia. El tratamiento podría aplicarse a
los enfermos, bien extrayéndoles sangre, iluminándola y
transfundiéndola de nuevo en el paciente (fototerapia extracorpórea),
o bien iluminando su piel con luz roja, en la llamada fototerapia transdérmica.
En la metodología transdérmica, la luz eliminaría
de la circulación sanguínea las células inmunitarias
activas conforme fueran pasando por la piel. La cuestión de si
esta técnica tendrá la potencia suficiente para eliminar
las células inmunitarias enfermas en los pacientes infectados por
VIH está todavía sin respuesta.
Las enfermedades autoinmunitarias, el rechazo de órganos transplantados
y las leucemias se encuentran enhebradas por el hilo común de la
aparición de células inmunitarias activadas y proliferantes.
En las enfermedades autoinmunitarias, determinados componentes de nuestro
organismo provocan por error la activación de células del
sistema inmunitario. Seguidamente, estos clones activados proliferan,
listos para destruir el supuesto peligro; por ejemplo, la vaina de mielina
en la esclerosis múltiple o el colágeno en la artritis reumatoide.
En los trasplantes de órganos, las células inmunitarias
activas pueden multiplicarse para rechazar el tejido foráneo: el
órgano transplantado e incluso los tejidos del nuevo hospedador,
en el caso de transplantes de médula ósea. En la leucemia,
las células inmunitarias y sus precursoras de la médula
ósea producen un gran número de células no funcionales.
En todos los casos, la TFD podría eliminar las células inmunitarias
indeseables, respetando al mismo tiempo las células quiescentes,
con el fin de mantener una respuesta inmunitaria normal ante una infección.
Lo mismo que el caso de la infección por VIH, el procedimiento
podría funcionar por vía extracorpórea o transdérmica.
Gran parte de estas investigaciones se encuentran en fases
preclínicas avanzadas o en de ensayo clínico inicial. En
vista del gran ingenio dedicado a la exploración de posibles aplicaciones
médicas, empero, sólo cabe esperar que los estudios clínicos
más extensos rindan fruto. |