La glicación de
las proteínas y su participación en enfermedades humanas
PARTE II
F. Luis González Flecha, Pablo R. Castello, Juan J. Gagliardino*
y Juan Pablo F.C. Rossi
Instituto de Química y Fisicoquímica Biológicas,
UBA – CONICET *Centro de Endocrinología Experimental y Aplicada,
UNLP – CONICET
La glicación de proteínas en
la diabetes y el envejecimiento
En los pacientes diabéticos descompensados, la concentración
de glucosa en la sangre, que en individuos sanos está sometida
a un cuidadoso mecanismo de regulación, se encuentra sustancialmente
aumentada. Además, tanto la falta de insulina cuanto la falta de
respuesta de los receptores celulares para esta hormona hace que las células
musculares y del tejido adiposo, que normalmente son los principales consumidores
de glucosa, no puedan transportar este azúcar hacia el interior
celular para su uso como fuente de energía. El resto de las células
del organismo no requiere de insulina para captar glucosa, de modo que
al aumentar la concentración de glucosa extracelular también
aumentará la concentración de glucosa intracelular. De ese
modo se favorece la glucosilación de gran número de proteínas
tanto intra como extracelulares.
Como ya se ha mencionado en la parte I, las proteínas de vida media
corta (como las del plasma sanguíneo) y aquellas que están
presentes en células que viven poco tiempo (como es el caso de
los glóbulos rojos) alcanzan a formar bases de Schiff o productos
de Amadori. Se ha encontrado que estos compuestos están asociados,
por ejemplo, al desarrollo de alteraciones de los vasos sanguíneos,
alteraciones en el riñón, y al anormal funcionamiento del
mecanismo de transporte del calcio (véase recuadro “La glicación
de la bomba de calcio de la membrana plasmática” en:
http://www.ciencia-hoy.retina.ar/
hoy58/glicacionc2.htm).
Por otro lado, las proteínas de larga vida media como por ejemplo
el colágeno, la mielina y la proteína del cristalino del
ojo pueden llegar a transformarse en productos de glucosilación
avanzada. Estos AGEs podrían estar implicados en el desarrollo
de diversas patologías debidas a:
1. la glicación de proteínas estructurales que se encuentran
fuera de la célula;
2. el desencadenamiento de procesos intracelulares a través de
la unión de AGEs a receptores celulares accesibles desde la superficie
extracelular de la célula;
3. la glicación de proteínas intracelulares.
En lo que sigue se dan algunos ejemplos que permitirán una mejor
visualización sobre cómo operan estos mecanismos.
El componente fundamental de la matriz extracelular es una proteína
llamada colágeno (figura 4 A, B y C). Cuando la glucosilación
se produce en el colágeno localizado en las paredes arteriales
y en los capilares sanguíneos pueden aparecer productos de entrecruzamiento
no solo con otras moléculas de colágeno sino también
con algunas proteínas plasmáticas, que en circunstancias
normales son de vida media corta, como por ejemplo la albúmina,
las inmunoglobulinas y las lipoproteínas de baja densidad. De esto
resulta el engrosamiento y la disminución de la flexibilidad de
las arterias y cambios en la permeabilidad de los capilares. Por este
motivo se ha sugerido que la glucosilación estaría involucrada
en el desarrollo de enfermedades vasculares, incluyendo la ateroesclerosis,
y de trastornos renales. Esto último tendría lugar por daño
a los capilares glomerulares que son los encargados de filtrar el plasma
sanguíneo para que el riñón cumpla su función
depuradora del medio interno.
(Ver figura 4).
Muchos de los efectos nocivos de los AGEs serían mediados por la
unión a moléculas específicas (pertenecientes a la
familia de las inmunoglobulinas) localizadas en la superficie de células
tales como las células endoteliales, los monocitos, los macrófagos
y las células del músculo liso de los vasos sanguíneos.
La unión de los AGEs a estos receptores desencadena la generación
de radicales libres de oxígeno, que modularían la función
celular induciendo, por ejemplo, procesos inflamatorios y la activación
de sistemas de eliminación de la proteína modificada. Además
de la destrucción celular mediante procesos inflamatorios, los
productos de glucosilación avanzada actuarían como inductores
de la muerte celular programada o apoptosis.
Mediante anticuerpos específicos que reconocen a los productos
de glucosilación avanzada se han detectado estos compuestos en
el cerebro de individuos con enfermedad de Alzheimer y otras patologías
neurodegenerativas. Estos AGEs tienen localización preferencial
en algunas estructuras características de estas enfermedades tales
como las placas seniles y los manojos neurofibrilares. Además se
postula que estos AGEs también inducen el aumento de especies reactivas
del oxígeno (estrés oxidativo) con el consecuente daño
neuronal. Si bien esto no es suficiente para establecer un papel causal
preponderante de los AGEs en la génesis de la enfermedad de Alzheimer,
es consistente con tal hipótesis.
Los efectos biológicos de los AGEs no se restringen exclusivamente
a quienes sufren de diabetes o tienen edad avanzada. En personas no diabéticas
con insuficiencia en la función renal se observa la acumulación
en el plasma de la sangre de proteínas modificadas hasta la etapa
AGE debido a la falla de los mecanismos responsables de la transformación
y eliminación de compuestos carbonílicos altamente reactivos
(este proceso se llama estrés carbonílico).
Si bien hasta ahora sólo se ha mencionado la glicación de
las proteínas, también puede glicosilarse el ácido
desoxirribonucleico (ADN). Esto se debe a que el ADN –cuyo recambio
es lento cuando las células no se encuentran en proceso de división–
posee grupos amino primarios y se ubica dentro del núcleo celular
en contacto con el azúcar reductor ADP-ribosa. Esto convierte al
ADN en un candidato potencial para la formación de productos de
glucosilación avanzada, hecho que efectivamente ha sido verificado
en ensayos in vitro. Estos AGEs contribuirían a aumentar las alteraciones
cromosómicas y al deterioro de la reparación, replicación
y transcripción del ADN. Dichos cambios en el material genético
disminuirían la capacidad de las células para renovar sus
proteínas, comprometiendo la supervivencia del organismo.
Gran parte de los esfuerzos en el cuidado de la salud se dirigen actualmente
a evitar las enfermedades relacionadas con el envejecimiento. Para esto
es necesario mejorar la comprensión de las bases biológicas
de los procesos que conducen a este estado. Los mecanismos que favorecen
el envejecimiento actúan dañando distintos componentes del
organismo incluyendo al ADN y a las proteínas y provienen de fuentes
exógenas y endógenas. Entre las exógenas, se encuentran
las radiaciones (luz ultravioleta, radiactividad, rayos X, etc.) y las
sustancias que no se encuentran normalmente en el organismo (ciertos medicamentos,
algunos componentes de los alimentos, contaminantes ambientales, etc.).
Los factores endógenos son generados como consecuencia del metabolismo
e incluyen principalmente el calor corporal, los radicales libres y los
azúcares reductores. El envejecimiento y la diabetes se relacionan
de manera tal que el efecto de la diabetes sobre muchos órganos
y tejidos a menudo se describe como un envejecimiento acelerado. Muchas
de las complicaciones que afectan a los pacientes diabéticos tales
como las cataratas, la hipertensión arterial, el aumento de la
susceptibilidad a infecciones y la ateroesclerosis representan la aparición
precoz de procesos idénticos a alteraciones que se presentan en
la vejez.
Se han propuesto varias teorías para explicar los procesos de envejecimiento.
La teoría del estrés oxidativo postula como la principal
causa de envejecimiento al incremento en el daño oxidativo con
la edad. La teoría mitocondrial establece que la fuerza impulsora
en el proceso de envejecimiento sería la acumulación de
mitocondrias dañadas por efectos de estrés oxidativo. La
teoría de la glicación sugiere que el entrecruzamiento generado
en proteínas y ácidos nucleicos por glucosilación
no enzimática contribuiría al decaimiento de las funciones
del organismo propias del envejecimiento. Por otro lado se postula que
el aumento de la concentración de (Ca2+) intracelular sería
uno de los principales factores en la regulación de la injuria,
muerte accidental o programada, proliferación, diferenciación
y envejecimiento celulares.
En la actualidad se proponen hipótesis unificadas del envejecimiento
como la denominada red deletérea del envejecimiento, que incluye
la interacción del deterioro oxidativo, de defectos mitocondriales,
de anomalías en el metabolismo del calcio y de reacciones de glicación
de proteínas. Se ha comprobado que estos factores presentan estrechas
vinculaciones entre sí. Las reacciones que conducen a los productos
de glucosilación avanzada pueden generar intermediarios reactivos
del oxígeno y, al mismo tiempo, el oxígeno y las reacciones
de oxidación pueden acelerar las reacciones de glicación.
Por otro lado, en este laboratorio se ha demostrado el efecto de la glicación
sobre la bomba de Ca2+ que conduciría al aumento de la concentración
de Ca2+ intracelular (ver recuadro “La glicación de la bomba
de calcio de la membrana plasmática” en:
http://www.ciencia-hoy.retina.ar/
hoy58/glicacionc2.htm).
Dichas hipótesis unificadas postulan que en organismos vivos los
factores de agresión, tanto internos como externos, producirían
la acumulación –que depende de la edad– de factores
desencadenantes. Cuando esta acumulación llega a un nivel crítico
se activa la red deletérea del envejecimiento. Las teorías
unificadas proveen explicaciones consistentes para un gran número
de cambios vinculados al envejecimiento.
¿Se puede evitar la glicación
de las proteínas?
(Ver imagen ampliada)
Gran parte de los esfuerzos actuales en la investigación
de los procesos de glucosilación no enzimática están
dedicados a la búsqueda de procedimientos que permitan inhibirlos
o evitar sus efectos. In vitro, esto es posible modificando los factores
que aceleran estas reacciones mediante procedimientos tales como la
disminución de la temperatura, el bloqueo del grupo amino por
acidificación del medio de reacción o del grupo carbonilo
con compuestos químicos tales como el sulfito de sodio. La aplicación
de estos procedimientos permite retardar la glucosilación hasta
prácticamente detenerla. Algunas de estas estrategias han sido
implementadas eficazmente en la industria alimenticia para prevenir,
durante la industrialización de los alimentos, la pérdida
del valor nutritivo y la generación de productos tóxicos
y agentes mutagénicos producidos por glicación.
Sin embargo, estos métodos no son aplicables al control de los
efectos de la glicación en condiciones fisiológicas ya
que son incompatibles con la vida. Una estrategia posible consiste en
evitar el avance de la reacción una vez formada la base de Schiff.
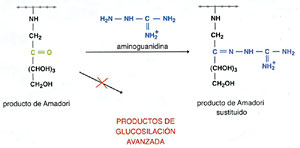
Esto requiere el bloqueo de los compuestos carbonílicos altamente
reactivos (producto de Amadori y compuestos dicarbonílicos) que
se formaron durante las primeras etapas de la glicación (ver
figura 3 de la parte I). Para lograr esto se han ensayado derivados
de la hidrazina, que tienen mayor reactividad que los grupos amino frente
a los compuestos carbonílicos; de ellos, el que resultó
más eficaz fue la aminoguanidina.
Esta inhibe in vitro la formación de productos de glucosilación
avanzada en el colágeno, y su administración a ratas diabéticas
inhibe la acumulación de productos de glucosilación avanzada
y el entrecruzamiento en el tejido conectivo de la pared arterial. Actualmente
la aminoguanidina se encuentra en la fase final de sus ensayos clínicos
para su utilización en el tratamiento de las complicaciones renales
asociadas a la diabetes.
Recientemente se han descrito nuevas variedades de compuestos químicos
capaces de bloquear la conversión de los productos de Amadori
en AGEs. Entre ellos se encuentran las denominadas genéricamente
amadorinas. Los estudios realizados hasta el presente muestran que la
inhibición no se produce a través del mecanismo descrito
para la aminoguanidina. La más potente de estas sustancias es
un análogo de la vitamina B6, la piridoxamina. Los resultados
obtenidos permiten suponer que la aplicación de esta molécula
podría ser efectiva en el tratamiento y prevención de
las complicaciones de la diabetes.
La aminoguanidina se combina con el producto de Amadori evitando la
formación de productos de glucosilación avanzada (AGEs).
Lecturas sugeridas
Baynes, J.W., Monnier, V.M., 1989, “The Maillard reaction in aging,
diabetes and nutrition”, Progr. Clin. Biol. Res., Vol. 304.
Brownlee, M., 1995, “Advanced protein glycosylation in diabetes and
aging”, Annu. Rev. Med., 46, 223-234.
González Flecha, F.L., Castello, P.R., Gagliardino, J.J. & Rossi,
J.P.F.C., 1999, “Molecular characterization of the glycated plasma
membrane calcium pump”, J. Membrane Biol., 171, 25-34.
Sitios en Internet
- The Glycation Homepage: http://www.geocities.com/CapeCanaveral/8824/
- 78 ways sugar can ruin your health: http://www.rheumatic.org/sugar.htm
- Maillard Reaction:
http://chemistry.miningco.com/library/
weekly/aa122898a.htm
|